摘要 木聚糖酶(Xylanase)是指将木聚糖降解成低聚糖和木糖的一组酶的总称,是木聚糖降解酶系中最关键的酶,在饲料、造纸、食品和生物转化等行业应用广泛。本文从木聚糖酶的研究近况、生物学特性、生产菌种、发酵工艺以及研究热点等方面进行了综述。
关键词 木聚糖酶;微生物;发酵
木聚糖酶(xylanase)是指可将木聚糖降解成低聚糖和木糖的一组酶的总称,主要包括外切β-1,4-木聚糖酶、内切β-1,4-木聚糖酶和β-木聚糖酶。木聚糖酶在饲料、食品、造纸、纺织、医药及能源等领域有着广泛的应用。木聚糖酶用作饲料酶制剂,可以有效解除木聚糖的抗营养作用,促进畜禽对粗饲料的消化吸收;木聚糖酶作为新型的纸浆漂白助剂,降低漂白用氯,解决纸浆工业中的环境污染问题;木聚糖酶水解植物中的半纤维素,形成的戊糖进一步用于生产木糖醇、酒精、有机酸等产品,在可再生资源生物转化利用中具有重要作用。
由于木聚糖酶有着广泛的应用价值,越来越多的研究者对它进行广泛而深入的研究。本文从木聚糖酶的研究近况、生物学特性、生产菌种、发酵工艺以及研究热点等方面进行了综述。
1 木聚糖酶的研究近况
国外对木聚糖酶的研究开较早。1955,Sorensen年就对动物瘤胃和土壤中的木聚糖酶进行了研究。1992年就已实现了木聚糖酶的工业化生产。目前国际上研究工作主要集中在对微生物木聚糖酶的诱导与调节机理研究,以及酶的提纯、鉴定方法,木聚糖酶基因分子的克隆和表达等(Neeta等,1999;Raffaele等,2004)。自上世纪七十年代末开展木聚糖酶基因的研究工作以来,已有150多种来自真菌和细菌的木聚糖酶基因被克隆并在大肠杆菌中表达。
我国在木聚糖酶方面的研究起步较晚,但发展迅速。上世纪八十年代初期,中国科学院微生物所在张树政院士(曾宇成等,1987)的带领下,开始了我国对木聚糖酶的早期研究工作,首次从海枣曲酶(Aspergillus phoenicis)中纯化得到了四种木聚糖酶:酶I、酶Ⅱ、酶Ⅲ和酶Ⅳ,并深人研究了活力较高的组分酶Ⅲ的酶学性质。“九五”期间,山东大学微生物技术国家重点实验室曲音波教授等(曲音波等,2001)开展了木聚糖酶在造纸方面的应用研究,从碱性假单胞菌sp. G6-2分离出两种木聚糖酶XynA和XynB。目前,我国对木聚糖酶的研究大多停留在产酶菌株的筛选和驯化、木聚糖酶的纯化和理化性质研究方面,部分课题已涉及木聚糖酶的分子生物学研究、木聚糖酶基因克隆、表达和重组。
2 木聚糖酶的生物学特性
木聚糖酶是一组可将木聚糖降解成低聚糖和木糖的复合酶系。一个木聚糖分子的完全酶解需要酶系统中不同组分之间的协同作用,其中作用于主链的酶有两种:β-1,4-内切木聚糖酶和β-木糖苷酶。一般而言,前者从主链内部作用于木糖苷键,将木聚糖分解成低聚木糖,而后者则作用于低聚木糖的末端,释放出木糖 (Prade等,1996)。木聚糖酶由功能或非功能结构域与连接区组成,功能结构域又可进一步分为催化结构域和纤维素结合结构域。木聚糖酶的催化结构域决定酶的水解特性,并作为该酶分类的基础,非功能结构域主要是连接序列。木聚糖酶广泛存在于细菌、放线菌、真菌和酵母菌。目前已经从微生物中分离出许多不同性质的木聚糖酶。按照其氨基酸序列的同源性,木聚糖酶被归入多糖代谢酶类的第10、11组。这两组木聚糖酶在作用方式、分子量、碱性和酸性氨基酸的比例等方面均有较大差别。根据酶的理化特性,可分为两大类,即分子量小于30 kD的木聚糖酶和分子量大于30 kD的木聚糖酶。前者通常为碱性蛋白,后者通常为酸性蛋白。通常细菌可产生两种木聚糖酶,即低分子量的碱性木聚糖酶和高分子量的酸性木聚糖酶,但真菌一般只产生低分子量的碱性木聚糖酶。对于不同生物来源的木聚糖酶,分子量范围为8~145kD,生长pH范围为pH3~10.5,大多数酶反应的最适pH范围为4~7,最适反应温度为40~60℃。不同木聚糖酶的等电点的变化范围在pH3~10之间。
3 木聚糖酶生产菌种
到目前为止,产木聚糖酶的微生物有几十个属,一百多个种,主要来源于细菌和真菌。研究者们不断的寻找着自然界中能高效表达木聚糖酶的菌种,并且利用基因工程技术构建出新的菌株。
3.1 细菌
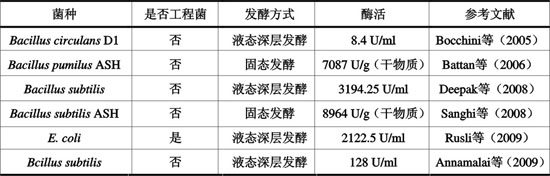
大多数细菌属于体温型微生物,适宜生长温度在35~40℃左右,比一般真菌(20~25℃)要高,所以在细菌中更易于筛选到耐热性能好的产酶菌株。并且,细菌属于原核生物,其细胞结构及基因重组简单,易于利用基因工程及诱变育种筛选出高产菌株。常用与表达木聚糖酶的细菌主要有杆菌和放线菌,其中大肠杆菌被用作基因工程宿主菌。近年来部分研究成果见表1。
表1 近年细菌木聚糖酶的研究
3.2 真菌
丝状真菌对木聚糖酶的分泌水平一般超过酵母和细菌很多,同时真菌中一般产生木聚糖降解酶系,其中包括几个能降解木聚糖支链的辅助酶。在真菌发酵木聚糖酶方面,霉菌和毕赤酵母应用最为广泛。
3.2.1 霉菌
霉菌具有许多表达木聚糖酶的基因,产酶水平高于酵母菌和细菌,在木聚糖酶的发酵方面应用最为广泛。目前用于表达木聚糖酶的霉菌主要有黑曲霉(Aspergillus niger)、青霉菌(Penicillium canescens)、伯克霍尔德氏菌(Burkhloderia sp.)、嗜热拟青酶(Paecilomyces themophila)、里氏木霉(Trichoderma reesei)、绿色木霉(Trichoderma virides)等。近几年的研究成果见表2。
表2 近年霉菌木聚糖酶的研究

3.2.2 毕赤酵母
毕赤酵母(Pichia pastoris)能以甲醇为唯一碳源和能源生长,细胞中醇氧化酶(AOX)是甲醇利用途径中的第一个酶,它催化甲醇氧化成甲醛和过氧化氢,该酶由AOX1和AOX2两个基因编码。毕赤酵母发酵过程一般分为两个时期,首先是菌体生长期,主要以甘油为碳源,大量获得菌体;然后是产物表达期,甘油耗尽后,加入适量甲醇诱导产物表达。
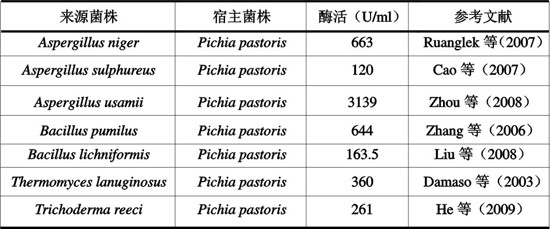
He等(2009)对来源于Trichoderma reesei编码内切-β-1,4-木聚糖酶的Xyn2基因在毕赤酵母中表达进行了研究,发现其发酵的重组木聚糖酶最适反应温度为60℃,pH作用范围为3.0~8.0,pH为6.0时,酶活达到最高。该重组木聚糖酶稳定性很好,50℃,30min后仍保留94%的活力。
Ruanglek等(2007)对一株重组毕赤酵母进行研究,发现其表达的重组木聚糖酶最适反应温度为55℃,比原木聚糖酶提高了5℃,pH作用范围为3.6~6.5,并且在pH5时具有最高酶活(8007 U/mg),相对部分商业酶,该酶对米糠和大豆粉纤维的体外消化率分别提高1.8和2.4倍。
4 木聚糖酶的发酵工艺
当前,木聚糖酶主要通过真菌、细菌等微生物发酵生产获得。根据发酵工艺的不同,可分为固态发酵和液态发酵两种。
4.1 固态发酵
固态发酵是传统的发酵方式,菌种大多是霉菌,对设备要求不高,控制简单。固态发酵所用培养基相对便宜,主要以农副产品为主,且操作设备简单,整个生产过程中无废物产生,不在环境污染问题,产率较高。但固态发酵同时也存在不易控制,酶系复杂,纤维素等酶含量高,难以精酶化等缺点。
Xu等(2008)采用响应面法对Aspergillus niger XY-1固体发酵产木聚糖酶的培养基组成进行了优化。优化后培养基组成为麸皮:营养液=1:1,营养液的组成有(g/L):尿素 41.63,NaCO3 2.64,MgSO4 10.68,28℃培养48 h酶活达到了14637 U/g干物质。
Lakshmi等(2009)对Aspergillus terreus MTCC 8661产木聚糖酶的固态发酵进行了优化,该研究以颗粒大小为2.1~2.8mm的棕榈为培养基,并加入含有0.4%木聚糖和0.7% NaNO3营养液,初始含水量为300%,培养基初始pH为6.0, 35℃培养60 h酶活达到了115000 U/g干物质,比优化前提高了227%。
Mohana 等(2008)采用响应面法对Burkholderia sp. DMAX 固体发酵产木聚糖酶的条件进行了优化,优化后木聚糖酶活力最高达到了5600 U/g干物质。
Assamoi等(2010)用青霉菌固体发酵木聚糖酶也成效显著,以5mm 的soya oil cake 为培养基,分别加入3%和4%的酪蛋白胨和Na2HPO4·2H2O,初始含水量为80%,30℃培养7 d酶活达到了18895 U/g干物质。
4.2 液体发酵
液态深层发酵是液态发酵的常用发酵方式,已经成为发酵工业的主导方式,该方法便于在生产过程中进行实时检测、控制,易于扩大生产规模。同时,由于液体输送方便,便于机械化操作,产品也易于提取精制。目前,液态深层发酵包括分批发酵,连续发酵和细胞循环发酵等。
Yasser等(2008)对Aspergillus niger SS7液体深层发酵产木聚糖酶的条件进行了研究。该研究表明,以3%的玉米芯为培养基,初始pH为7.0,发酵120 h后木聚糖酶活力达到最高,为293.82 IU/ml。
细胞循环发酵是液态发酵的一个分支,目前已经应用到木聚糖酶的研究中。Ferreira等(2006)利用毕赤酵母GS115进行了木聚糖酶表达的细胞循环发酵研究,该研究每12h补一次甲醇,分别在24,48,72 h循环细胞,研究发现木聚糖酶的产量并没有随着细胞循环次数的增加而降低,当初始细胞浓度为2.5 g/L时,4次细胞循环之后,经甲醇诱导24 h酶活达到14050 U/L,然而,当最初细胞浓度为0.25 g/L时,在细胞循环3次和4次之后酶活分别下降30%和75%。
5 木聚糖酶研究热点
5.1 基因工程
利用基因重组技术,将产生木聚糖酶的基因在合适的宿主中表达,可得到纯度较高的木聚糖酶。原核表达系统操作简单、周期短、易于大规模高密度培养、成本低,但大多数构建的原核基因工程菌比在亲本中产酶量低,且表达产物存在于细胞质或周质腔内,商业价值不高。近年来,木聚糖酶基因工程已把宿主菌从大肠杆菌等原核生物扩展至酵母、霉菌等真核微生物以及植物,通过构建合适的表达载体及采用适宜的宿主等手段使某些木聚糖酶基因得到高效表达,并可将表达产物分泌到胞外(An等,2005;Zhang等,2008)。
目前常用的真核表达系统主要是酵母表达系统,其中应用最广泛的是毕赤酵母(Cregg等,1985)。研究者通过基因工程技术,已经构建出许多表达木聚糖酶的毕赤酵母工程菌。部分工程菌及其木聚糖酶活力见表3。
表3 毕赤酵母工程菌构建
5.2 蛋白质工程
蛋白质工程是在重组DNA方法用于操纵蛋白质结构之后发展起来的分子生物学分支,它通过修饰蛋白质的基因或改变结构来获得具有新特性的蛋白质。目前用于木聚糖酶蛋白质工程的相关技术有定点突变技术(Bergquist等,2005)、向木聚糖酶分子中引入二硫键技术(Jeong等,2007)和蛋白质体外定向进化技术(Johannes等,2006)。
Georis等(2000)建立了木聚糖酶xyl1和TfxA的分子模型,并将TfxA中的嗜热结构用定点突变法引入xyl1酶中,以提高其最适反应温度和热稳定性。将xyl1第11位的苏氨酸残基突变为酪氨酸(T11Y),结果突变酶的最适温度由原来的60℃提高到70℃,57℃条件下,酶的稳定性比原来提高了6倍。
5.3 固定化细胞技术
固定化细胞技术具有较高稳定性和较高抗污染能力等优点,现已应用于木聚糖酶的研发中。Sanjay等(2008)将Trichoderma reesei SAF3 的孢子固定在海藻酸钙微球中,对其产木聚糖酶的条件作了研究,结果发现木聚糖酶的产量随着海藻酸盐浓度的提高而显著提高,海藻酸盐浓度为2%(W/V)时得到最高酶活为3.12±0.18 U/ml。通过对该固定细胞重复利用发现其可连续利用10次,且在第4次时产酶量最高为3.36±0.2 U/ml。
5.4 离子束诱变育种技术
离子束诱变育种是一种新型的诱变育种方式,与传统的诱变育种方式比较,表现出较高突变率和诱变效率,因此在微生物诱变育种方面具有很好的发展前景。离子束诱变在木聚糖酶产生菌的诱变育种方面也发挥了巨大的作用。Wu等(2005)将低能氮离子(10KeV,1.04×1015-2.08×1015 ion/cm2)注入Aspergillus niger,并分离出突变株P602,该突变株的生长温度范围在28-30℃,比原始菌株有生长范围更广,且木聚糖酶的酶活从2989 U/g提高到6320 U/g,发酵时间从72 h缩短到64 h。
6 展望
由于木聚糖酶具有重要的应用价值以及在生物工程技术的重要地位,现在已经有越来越多的科研人员致力于木聚糖酶的开发研究。随着基因突变技术和蛋白质高级结构研究技术的进展,大量性质各异的木聚糖酶,尤其是在极端微生物中获得的具有极端性质的木聚糖酶,有望使木聚糖酶的结构与功能研究取得突破性进展,将为解决人类发展中遇到的能源、粮食、环境等诸多问题上发挥出它所特有的优势和潜力。加强木聚糖酶的研究和开发不仅是可持续发展和构建和谐社会的有效途径,在世界范围也具有深远的现实意义。
Reference
[1] Sorensen H. Xylanase in the soil and rumen[J]. Nature, 1955, 176(4471): 74.
[2] Neeta K, Abhay S, Mala R. Molecular and biotechnological aspects of xylanase [J]. FEMS Microbilogy Reviews, 1999, 23(4): 411~456.
[3] Raffaele C, Natascia D P, Mose R, et al. A xylan-degrading sulfolobus solfataricus: isolation and characterization of the activity[J]. Extremophiles, 2004, 8(2): 117~124.
[4] 曾宇成,张树政.海枣曲霉产生的糖苷酶类[J].微生物学通报,1987,03:111~114.
[5] 曲音波,高培基,陈嘉川,等.麦草浆的生物漂白与酶法改性[J].中华纸业,2001,22(04):13~15.
[6] Prade R A. Xylanase: from biology to biotechnology[J]. Biotechnol GenetEngReV, 1996, 13: 101~131.
[7] Bocchini D A, Oliveria O, Gomes E, et al. Use of sugarcane bagasse and grass hydrolyastes as carbon sources for xylanase production by Bacillus circulans D1 in submerged fermentation[J]. Process Biochemistry, 2005, 40(12): 3653~3659.
[8] Battan B, Sharma J, Kuhad R C. High-level xylanase production by alkaliphilic Bacillus pumilus ASH under solid-state fermentation[J]. World Journal of Microbilogy and Biotechnology, 2006, 22(12): 1281~1287.
[9] Deepak V, Kalishwaralal K, Ramkumarpandian S, et al. Optimization of media composition for Nattokinase production by Bacillus subtilis using response surface methodology[J]. Bioresource Technology, 2008, 99(17): 8170~8174.
[10] Sanghi A, Garg N, Sharma J, et al. Optimization of xylanase production using inexpensive agro-residues by alkalophilic Bacillus subtilis ASH in solid-state fermentation[J]. World Journal of Microbiology and Biotechnology, 2008, 24(5): 633~640.
[11] Rusli F M, Mohamed M S, Mohanmad R, et al. Kinetics of xylanase fermentation by recombinant Escherichia coli DH5 in shake flask culture[J]. American journal of Biochemistry and Biotechnology, 2009, 5(3): 110~118.
[12] Annamalai N, Thavasi R, Jayalakshmi S, et al. Thermostable and alkaline tolerant xylanase production by Bacillus subtilis isolated form marine environment[J]. Indian Journal of Biotechnology, 2009, 8(3): 291~297.
[13] Xu Y X, Li Y L, XU S C, Liu Y, Wang X, Tang J W. Improvement of xylanase production by Aspergillus niger XY-1 using response surface methodology for optimizing the medium composition[J]. J Zhejiang Univ Sci B 2008, 9(7): 558~566.
[14] Maciel G M, Vandenberghe L P D. Xylanase production by Aspergillus niger LBP 326 in solid-state fermentation using statistical experimental designs[J]. Food Technology and Biotechnology, 2008, 46(2): 183~189.
[15] Yasser B, Manal A J, Ghassan A K. Xylanase production by a newly isolates Aspergillus niger SS7 in submerged culture[J]. Polish Journal of Microbiology, 2008, 57(3): 249~251.
[16] Lakshmi G S, Rao C S, Rao R S, Hobbs P J, Prakasham R S. Enhanced production of xylanase by a newly isolated Aspergillus terreus under solid state fermentation using palm industrial waste: A statistical optimization[J]. Biochemical Engineering Journal, 2009, 48: 51~57.
[17] Valte R D, Borude P C, Hule A K, Juvekar A R. Optimization of xylanase production from Aspergillus foetidus MTCC 4898 by solid state fermentation using statistical methods[J]. J Gen Appl Microbiol, 2010, 56: 75~80.
[18] Assamoi A A, Delvigne F. Improvement of xylanase production by Penicillium canecens 10-10c in solid-state fermentation. Biotechnologie Agronomie Societe et Environnement, 2008, 12(2): 111~118.
[19] Assamoi A A, Destain J, Philippe T. Xylanase production by Penicillium canescens on soya oil cake in solid-state fermentation[J]. Appl Biochem Biotechnol, 2010, 160: 50~62.
[20] Gaffney M, Doyle S, Murphy R. Optimization of production by Thermomyces lanuginosus in solid state fermentation[J]. Biosci Biotechnol Biochem, 2009, 73(12): 2640~2644.
[21] Sanghvi G V, Koyani R D, Raiput K S. Thermostable xylanase production and partial purification by solid-state fermentation using agricultural waste wheat straw[J]. Mycology, 2010, 1(2): 106~112.
[22] Mohana S, Shah A, Divecha J, Madamwar D. Xylanase production by Burkholderia sp. DMAX strain under solid state fermentation using distillery spent wash[J]. Bioresource Technology, 2008, 99(16): 7553~7564.
[23] He J, Yu B, Zhang K Y, et al. Expression of endo-1,4-beta-xylanase from Trichoderma reesei in Pichia pastoris and functional characterization of the produced enzyme[J]. BMC Biotechnology, 2009, 9: 56~65.
[24] Ruanglek V, Sriprang R, et al. Cloning, expression, characterization, and high cell-density production of recombinant endo-1,4-β-xylanase from Aspergillus niger in Pichia pastoris. Enzyme Microb Technol, 2007, 41: 19-25.
[25] Ferreira V, Nolasco P C. Evaluation of cell recycle on Thermomyces lanuginosus xylanase a production by Pichia pastoris GS 115[J]. Applied Biochemistry and Biotechnology, 2006, 129(1-3): 226~233.
[26] An J M, Kim Y K, Lim W J, et al. Evalution of a novel bifunctional xylanase cellulose constructed by gene fusion[J]. Enzyme and Microbial Technology, 2005, 36: 989~995.
[27] Zhang J X, Pan J, Guan G H, Li Y, et al. Expression and high-yield production of extremely thermostable bacterial xylanaseB in Aspergillus niger[J]. Enzyme and Microbial Technology, 2008, 43: 513~516.
[28] Cregg J M. Pichia pastoris as a host system for transformations[J]. Molecular Biology of the Cell, 1985, 5(12): 3376~3385.
[29] Cao Y, Qiao J, Li Y, Lu W. De novo synthesis, constitutive expression of Aspergillus sulphureus beta-xylanase gene in Pichia pastoris and partical enzymic characterization[J]. Appl Microbiol Biotechnol, 2007, 76: 579-585.
[30] Zhou C Y, Li D F, Wu M C. Optimized expression of an acid xylanase from Aspergillus usamii in Pichia pastoris and its biochemical characterization[J]. World Journal of Microbiology and Biotechnology, 2008, 24(8): 1393~1401.
[31] Zhang G M, Hu Y, Zhuang Y H, et al. Molecular cloning and heterologous expression of alkaline xylanase from Bacillus pumilus HBP8 in Pichia pastoris[J]. Biocatalysis and Biotransformation, 2006, 24(5): 371~379.
[32] Liu M Q, Liu G F. Expression of recombinant Bacillus lichniformis xylanase A in pichia pastoris and xylooligosaccharides released from xylans by it[J]. Protein Expression and Purification, 2008, 57: 101-107.
[33] Damaso M C T, Almeida M S, et al. Optimized expression of a thermostable xylanase from Thermomyces lanuginosus in Pichia pastoris[J]. Appl Environ Microbiol, 2003, 69: 6064-6072.
[34] Bergquist P L, Reeves R A, Gibbs M D. Degenetate oligonucleotide gene shuffling (DOGS) and random drift mutagenesis(RNDM): Two complementary techniques for enzyme evolution[J]. Biomolecular Engineering, 2005, 22: 63~72.
[35] Jeong M Y, Kim S, Yun C W, et al. Engineering a de novo in ternal disulfide bridge to improve the thermal stability of xylanase from Bacillus stearothermophilus No. 236[J]. Journal of Biotechnology, 2007, 127: 300~309.
[36] Johannes T W, Zhao H M. Directed evolution of enzyme and biosynthetic pathways[J]. Current Opinion in Mircobiology, 2006, 9: 261~267.
[37] Georis J, Lemos E F, Lamotte B J, et al. An additional aromatic intercation improves the thermostability and thermophilicity of a mesophilic family 11 xylanase: structural basis and molecular study[J]. Protein Sci, 2000, 9(3): 466~475.
[38] Sanjay K, Asish M, Pradeep M, et al. Production of xylanase by immobilized Trichoderma reesei SAF3 in Ca-alginate beads[J]. Journal of Industrial Microbiology and Biotechnology, 2008, 35(4): 245~249.
[39] Wu M, Li S C, Yao J M, Pan R R, Yu Z L. Mutant of a xylanase-producing strain of Aspergillus niger in solid state fermentation by low energy ion implantation[J]. World Journal of Microbiology and Biotechnology, 2005, 21(6): 1045~1049.