中国科学院天津工业生物技术研究所郭瑞庭研究组与江南大学生物工程学院堵国成院长和陈坚校长研究组合作,首次解析了来源于Pseudomonas sp. VM15C和Sphingopyxis sp. 113P3的氧化型聚乙烯醇水解酶(OPH)的晶体结构,这是迄今为止首个被解析出的PVA水解酶。同时,本研究获得OPH与底物抑制剂乙酰丙酮和辛酸的复合体的晶体结构,在此基础上模拟得到了OPH与底物OPA的复合体结构模型,并阐述了其催化反应机理,其中Ser172为亲核反应质子供体,His298和Asp253为质子传递者,Ser66与Val67,Ser173之间形成的两个“氧洞”结构用来稳定反应中间体。这一特点与α/β水解酶的单“氧洞”机制有所不同,从而揭示了OPH独特的反应机理。另外,通过对活性中心区域的三个重要氨基酸进行定点突变,获得的突变体W255Y、Y270F和R264A的催化活力(kcat/Km)比突变前提高了40-60%,为设计改造PVA水解酶以实现PVA的高效生物降解奠定了坚实的理论基础。
该研究得到国家863计划,长江学者和创新研究团队计划等项目的支持。相关研究成果发表在 ChemBioChem 和 Biochemical and Biophysical Research Communications 期刊上,在天津工业生物所客座培养的江南大学博士研究生杨钰和台湾中研院的柯子平博士为论文共同第一作者。
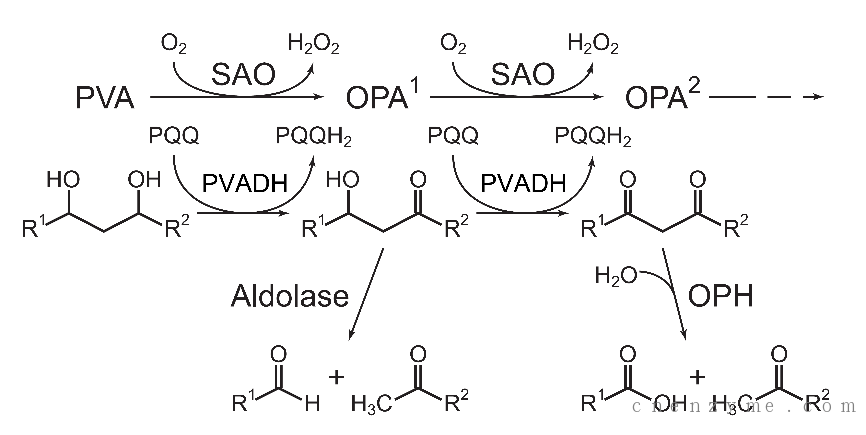
PVA降解机理图

模拟的OPH与底物OPA的复合体结构(封面文章)