摘译自:https://biotechnologyforbiofuels.biomedcentral.com/articles/10.1186/s13068-016-0550-x
摘要
2016年7月8号,biotechnology for biofuels期刊在线发表了题为:The GH51 α-L-arabinofuranosidase from Paenibacillus sp. THS1 is multifunctional, hydrolyzing main-chain and side-chain glycosidic bonds in heteroxylans的科研成果。
亮点:“首次”
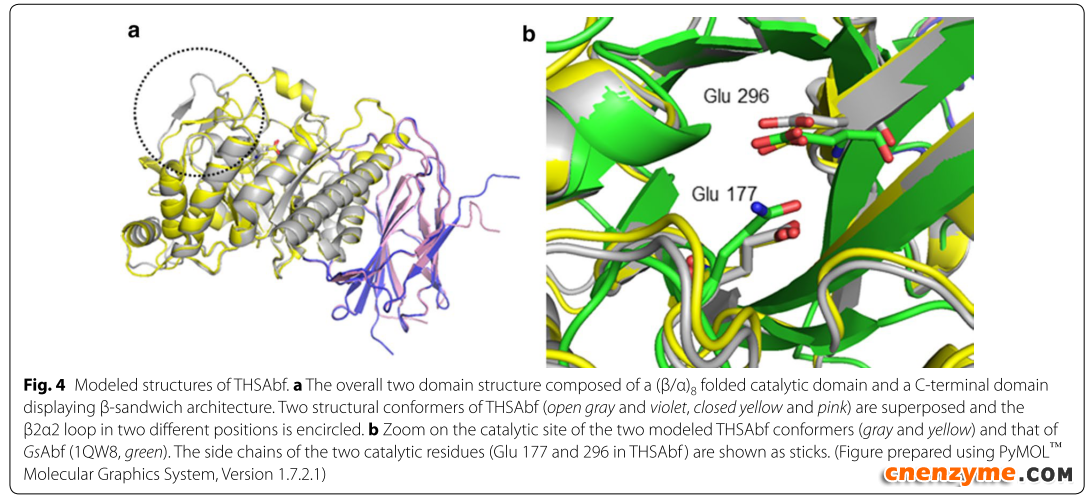
文献中发现了一种具有多个酶活性的蛋白质——THSAbf,该蛋白质来源于类芽孢杆菌,当然具有多个酶活性的蛋白质并不罕见,罕见在于这种酶有且只有一个催化活性中心,而之前报道的多功能酶往往具有多个活性中心,这是第一次发现,从而也拓宽了我们知识。
研究中对THSAbf进行了参数的研究,发现该酶具有木糖苷酶和内阿拉伯糖酶活性,对木聚糖的主链和侧链都可行驶切割作用,从而降解木聚糖。
为什么“一个中心,两种活性” ?
研究者利用分子对接(ligand docking)的方法建立的蛋白模型,研究发现,之所以只有一个催化活性中心却出现两种催化活性是因为该蛋白活性中心具有β2α2环,而这个环是可以移动的,这样在就出现了该酶具有两种活性。
关于该酶的其他研究
文章还研究了PH和温度对该酶活性的影响,研究表明该酶的活性PH范围比较宽,为4—7,而对于温度来说,该酶的活性温度则高达75℃,在60℃的情况处于稳定状态。
应用意义
该酶的发现不仅刷新了我们对现有酶的认识,而且研究者可以根据该酶不同于同类家族其他蛋白质的地方加以应用,改造其他的蛋白质(酶)或可使其他蛋白质具有这种技能,同时两用酶的发现本身就是一种福音,在降解某些物质的时候可以减少酶成本。