中科院天津工业生物技术研究所宋江宁研究员带领的结构生物信息学与整合系统生物学研究组针对GH-8家族的壳聚糖酶的底物识别进行了一系列深入研究。该研究从壳聚糖酶的晶体结构入手,对其底物识别中心的关键氨基酸残基进行鉴定,并通过序列对比发现第318位Asp氨基酸高度保守;将Asp318进行定点突变为Asn,Ala,Glu,Arg或Lys后,发现除D318N突变体外,其他的酶突变体活性均有明显丧失。进一步的酶动力学分析发现,突变体对底物的亲和性明显降低。分子内相互作用分析表明,Asp318通过与Tyr273之间的氢键间接作用于底物,除了D318N突变体外,其他突变体都丢失了与Tyr273发生相互作用的氢键,从而影响了底物与酶的有效结合。本研究加深了对GH-8家族壳聚糖酶酶解机制的了解,为壳聚糖酶的分子改造及工业化应用奠定了基础。
该研究得到中国科学院“百人计划”(择优)、中国科学院知识创新工程项目(KSCX2-EW-G-8)和天津市重大科技攻关项目(10ZCKFSY05600)的资助。研究结果发表在SCI杂志Applied Biochemistry and Biotechnology上,中国科学院天津工业生物技术研究所助理研究员周站平为论文第一作者。
文章链接
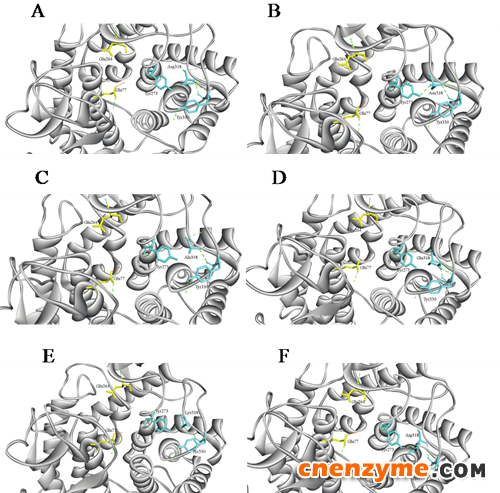
Asp318及其突变体与周围氨基酸之间的相互作用
(天津工生所供稿)