Cdc25A (M-phase inducer phosphatase 1)在多种人类肿瘤细胞中高表达。以往研究报道其主要通过去磷酸化CDKs (Cyclin-dependent kinases)发挥促进细胞周期进展的作用。然而,Cdc25A是否存在其他底物,及该底物的去磷酸化参与何种细胞功能并不清楚。杨巍维研究组的前期研究发现在EGFR (Epidermal growth factor receptor)激活的条件下,糖酵解关键酶PKM2 (Pyruvate kinase M2 isoform)可转运至细胞核,并通过表观遗传的方式调控一系列原癌基因的表达(Nature, 2011; Cell, 2012);PKM2的这种核转运能力依赖于其37位丝氨酸磷酸化(Nat Cell Biol 2013)。在该研究中,他们进一步发现细胞核内PKM2该位点的磷酸化需要被去除才能与β-catenin相互作用,并发挥表观遗传调控作用。更为深入的研究表明,PKM2磷酸化的去除由细胞周期相关磷脂酶Cdc25A完成,且两者之间的相互作用依赖于c-Src介导的Cdc25A第59位酪氨酸磷酸化。细胞及动物实验表明Cdc25A介导的PKM2去磷酸化在EGFR促进的胶质瘤发生、发展中起重要作用。临床样本的分析也进一步提示Cdc25A的磷酸化可很好地指示胶质瘤病人的预后。
杨巍维组副研究员梁冀为该论文第一作者。该项研究工作得到了中组部、国家科技部及国家基金委的资助。该研究数据收集工作得到生化与细胞所公共技术服务中心分子平台、细胞平台、动物平台的支持。
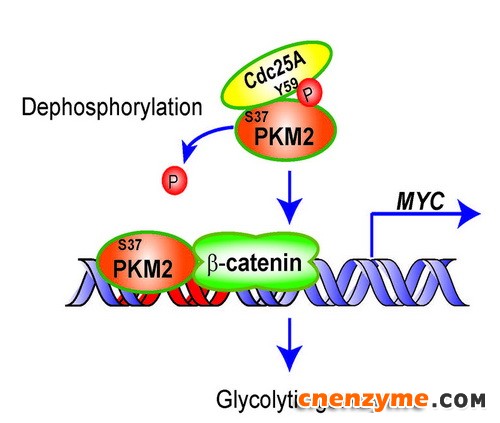
Cdc25A Y59磷酸化介导了其与PKM2的相互作用;与PKM2相互作用的Cdc25A去除了PKM2 S37的磷酸化,并促进了PKM2与β-catenin的相互结合,随后增强了c-Myc及下游糖酵解基因的表达。
编辑:叶瑞优
新闻来源:https://www.cas.cn/syky/201608/t20160808_4570801.shtml