中国科学院天津工业生物技术研究所研究员郭瑞庭、马延和以及美国伊利诺伊大学教授Eric Oldfield 联合攻关,经数年研究,解析了两种具有不同结构特征的新型“头-碰-中”萜类合成酶,并阐明了它们的作用机理。一种酶属于“头-碰-中”全α-折叠反式合成酶的MoeN5,另一种则属于“头-碰-中”蝴蝶样折叠顺式合成酶的熏衣草焦磷酸合成酶(Lavandulyl Diphosphate Synthase,LPPS)。
“头-碰-中”全α-折叠反式合成酶MoeN5负责合成重要抗生素莫诺霉素(抗菌活性为万古霉素的 10~1000倍,使用至今少有抗药性报导)的碳骨架。与典型“头-碰-尾”全α-折叠反式合成酶由小底物 IPP 结合在IPP位点去攻击大底物 FPP产生产物不同,MoeN5 催化更大底物FPG-sugar以“头-碰-中”的反应方式去攻击大底物 GPP。这种催化过程为首次报道,进一步揭开了十多年来萜类合成酶研究领域的谜团。MoeN5结构为全α-螺旋折叠的同源二聚体,活性区具有两个底物结合域。其中,结合 10 个碳底物GPP的区域构造与其它萜类合成酶相同,而结合 15 个碳底物FPG-sugar的构造则完全不同。在此区域利用三个较大的疏水性氨基酸挤压 C15,造成碳链尾端弯曲进而迫使 C7-C8 间的双键去攻击 C10 底物的双磷酸基团,最终形成特殊的 C25 产物(图1)。MoeN5在进行催化时,GPP 结合在大底物FPP结合位点中,FPG-sugar则结合在活性区外,将进行催化的长链伸入到FPP结合位点中,并完成催化反应。因此,MoeN5也可在无IPP结合位点的情况下,进行这种特殊的催化反应(图2)。
在MoeN5研究的初期,研究团队遇到了MoeN5 蛋白质晶体容易培养但分辨率低 (大于 3.5 Å)的问题,因此无法用来观察活性区的细部结构。为解决这个难题,郭瑞庭带领研究组尝试将MoeN5连接数种不同的小分子量蛋白质来改变晶格堆叠。最终,通过使用来源于嗜热菌的单体 DNA 结合蛋白Sso7d 与 MoeN5 的融合蛋白,成功结晶出高分辨率的晶体(约2.2 Å)。通过与小分子量的单体蛋白质(分子量 <10 kDa)的结合,在不改变主体蛋白质性质的前提下,可以成功改变晶格堆叠。该方法有望在存在类似问题的其他蛋白质结构解析研究中推广应用(图3)。
“头-碰-中”蝴蝶样折叠顺式合成酶—熏衣草焦磷酸合成酶LPPS,是一个全新的非典型萜类合成酶,以“头-碰-中”的方式缩合两个 DMAPP 分子产生分枝型萜类产物。LPPS为蝴蝶样折叠同源二聚体,其活性区具有两个小口袋,分别可容纳一个C5底物。LPPS和底物类似物的复合体结构显示,只有两个 DMAPP 分子可以稳定存在于这两个口袋中,进而发生缩合反应。反应中负责攻击第一个 DMAPP 双磷酸基团的 78 位组氨酸是催化反应发生的关键位点(图4)。
综上所述,此项研究解析了两个具有重要应用价值的不规则萜类化合物合成酶结构,揭示了它们的催化机理,对重要萜类化合物的生物合成及代谢工程改造具有重要指导意义。
以上研究获得了中科院知识创新工程项目(KSZD-EW-Z-015-2)和国家自然科学基金(31200053,31400678,31300615,31300615,31470240,31500642和31570130)的支持。研究结果在《德国应用化学》(Angewandte Chemie International Edition)杂志以背靠背(back-to-back)形式同时发表。其中LPPS成果获选为 VIP封面文章(图5)。天津科技大学联合培养硕士生刘美霞、天津工生所台湾青年学者陈纯琪和美国伊利诺伊大学博士研究生陈璐为LPPS文章的共同第一作者。天津工生所科研助理张丽兰、台湾青年学者陈纯琪和台湾中研院柯子平为 MoeN5 文章的共同第一作者。
文章链接:MoeN5 文章, LPPS 文章
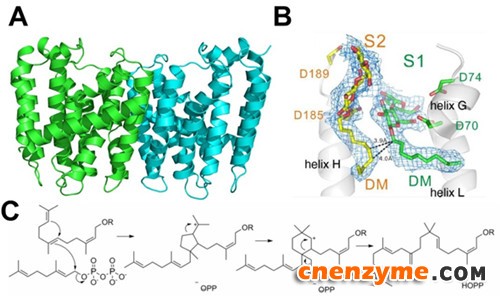
图1. A. MoeN5 晶体结构,为同源二聚体;B. 底物类似物电子云密度图;C. 推测的催化机理
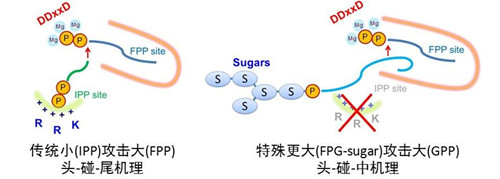
图2. 典型“头-碰-尾”全α-折叠反式合成酶和本文发表的 MoeN5 之不同的催化机理
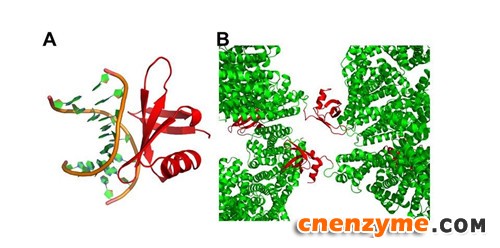
图3. A. Sso7d 和 DNA 的复合体结构;B. Sso7d和 MoeN5 融合表达,在晶体中增加了交互作用,长出不同晶格的晶体
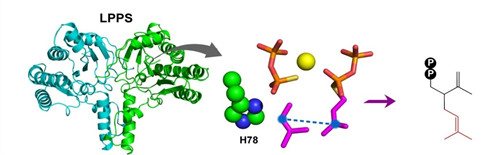
图4. LPPS 的晶体结构、底物结合情况及最终的产物(熏衣草醇碳骨架)

图5. 入选杂志VIP封面