美国加州大学伯克利分校(UC Berkeley)及能源部劳伦斯伯克利国家实验室(Berkeley Lab)的John F. Hartwig教授(点击查看介绍)最近的一项研究大大加快了仿生酶的催化速率。通过在天然酶上配位铱离子,并对活性位点的几个残基进行突变,科学家创造的“混血”酶每小时能转化2550个分子,这几乎可以媲美具有相似功能的天然酶了。该研究成果发表在Science上,它是人工金属酶领域的一项重大突破,为那些天然酶无能为力的反应带来了希望。(An artificial metalloenzyme with the kinetics of native enzymes. Science, 2016, 354, 102-106, DOI: 10.1126/science.aah4427)
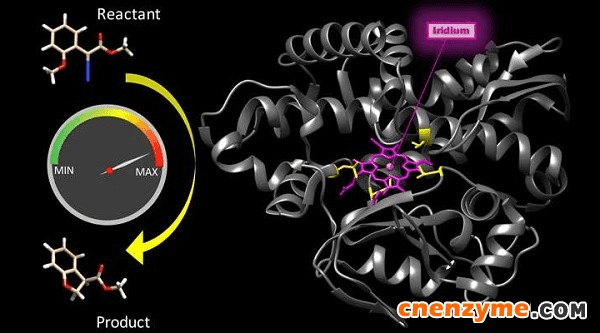
图1. 与天然酶相媲美的人工金属酶。图片来源:Hanna Key/Berkeley Lab
Hartwig表示:“我们的工作证明人工金属酶具有实际应用价值,而不是仅仅是科学家的花把势。”
Hartwig实验室在人工金属酶领域建树颇多,就在今年早些时候,他们曾在Nature报道用铱离子代替肌红蛋白(myoglobin)中的铁,使其能够催化原来的天然酶无法催化的反应(DOI: 10.1038/nature17968,点击阅读相关)。研究者当时选择肌红蛋白为研究对象是因为这是一种被研究得相当透彻的蛋白,易于操作。不过那项研究的一个缺点是新的仿生酶催化速率很低,比天然酶几乎要慢1000倍。Hartwig自己也承认:“我们创造的人工金属酶当然有催化作用,它加速了反应,但确实不如天然酶速率快。”
但反应速率是酶催化反应的核心要素之一,Hartwig无法回避这个问题。研究者这一次不再关注肌红蛋白,转而研究CYP119,细胞色素P450酶家族(CYP)的一员。CYP蛋白内含的卟啉会与铁离子络合,催化很多有机分子的氧化反应。
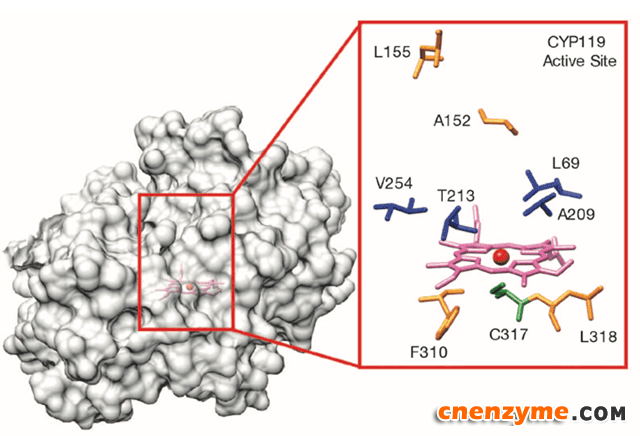
图2. CYP119的蛋白结构及活性位点。图片来源:Science
UC Berkeley的博士后Pawel Dydio与研究生Hanna Key一起完成了大部分实验工作,他们是本文的共同第一作者。
研究团队将CYP119的铁卟啉换成了铱卟啉,并不断突变活性位点的残基,测试催化活性。实验证明新的仿生酶催化速率提升了一个数量级,这使它在与天然酶的比较中获得了优势。
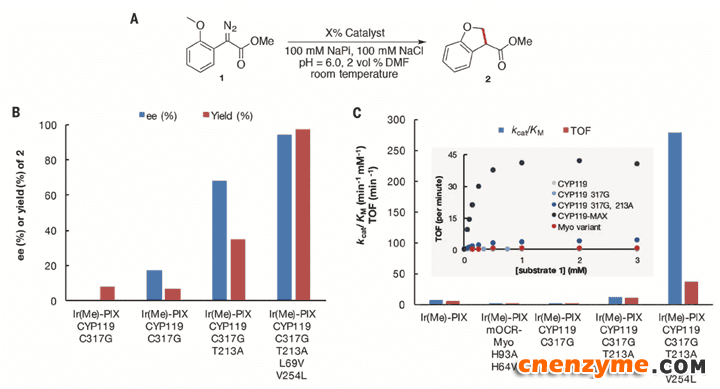
图3. CYP119仿生酶催化的模型反应及突变体催化性能,这种酶能催化C-H中插入卡宾的反应。图片来源:Science
除了高速率,CYP119仿生酶还具有其他一些优点,如:耐高温高压、能结合较大的有机分子、反应过程中不被消耗可重复使用等等。鉴于当前学术界对于人工金属酶的主要攻击点是“无实际应用价值”,Hartwig等人的工作确实很有意义。
由于人工金属酶能够催化的分子骨架非常多样,或许将来能在药物研发中发挥作用。而Hartwig没有停止脚步,他下一步打算设计出能由细胞生物合成并在细胞内发挥作用的人工金属酶。
氘评:
Hartwig连续两篇大作似乎表明更换金属核心(赋予催化某类反应的能力)和残基突变(提高速率、提高转化数)是制造高效的人工金属酶的通法,但我总感觉最开始挑选的天然酶很有讲究,不止是易得、易操作这么简单。
1. https://science.sciencemag.org/content/354/6308/102
2. https://phys.org/news/2016-10-scientists-rev-bionic-enzyme-reactions.html