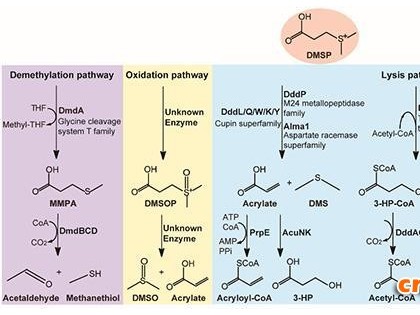
此外,纤维素降解糖苷水解酶中,5家族为数众多,具有纤维素酶和地衣多糖酶等活性,但双功能纤维素酶/地衣多糖酶底物的选择性机制尚不清楚。青岛能源所微生物资源团队与代谢物组学团队研究员冯银刚、仿真模拟团队研究员姚礼山以及清华大学教授王新泉合作,解析了极端嗜热厌氧菌Caldicellulosiruptor sp. F32的糖苷水解酶F32EG5的蛋白及蛋白底物复合体结构,揭示了底物选择性机制。该工作已在线发表在Biochemical Journal上。
研究团队发现F32EG5能够切断β-1,3-1,4-葡聚糖底物的β-1,3-糖苷键或β-1,3-糖苷键前面的β-1,4-糖苷键,与传统的GH16家族地衣聚糖酶(切断β-1,3-糖苷键后面的β-1,4-糖苷键)截然不同,是一种新的β-葡聚糖糖苷键切断方式。F32EG5具有典型的GH5家族蛋白(β/α)8桶状结构,具有独特的底物结合位点,决定了底物特异性。复合体结构显示,F32EG5具有一个急剧弯曲的底物结合孔道,与同样具有弯曲构象的β-1,3-1,4-葡聚糖底物特异结合,决定了该蛋白的高地衣聚糖酶活性。分子动力学模拟及定点突变分析验证了上述设想。
研究工作获得了科技部973计划、国家自然科学基金、山东省自然科学杰出青年基金、山东省重点研发计划等的支持。
论文链接:1 2
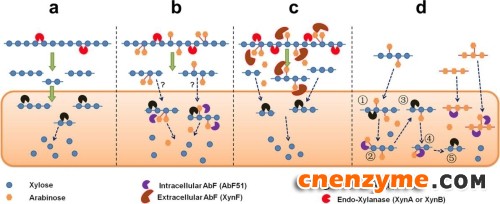
图1 Arabinofuranosidase协同降解带有阿拉伯糖侧链的半纤维素模式图
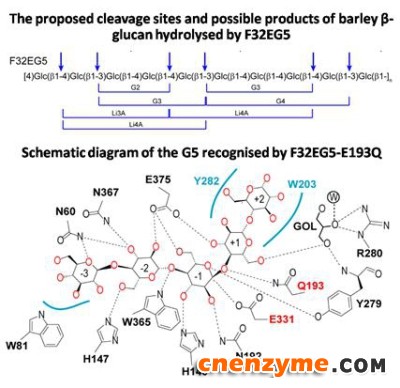
图2 F32EG5底物特异性作用机制