手性邻位氨基醇在生物活性分子中广泛存在,也是一类重要的药物结构砌块,例如抗结核病药物乙胺丁醇(Ethambutol)、抗艾滋病药物埃替格韦(Elvitegravir)等药物分子中都含有此类结构砌块。化学法合成手性的邻位氨基醇存在反应条件苛刻、选择性不高等问题。胺脱氢酶可以利用氨分子作为氨基供体催化羰基直接还原胺化生成相应的手性胺,被认为是一种有前景的手性胺绿色合成途径,但还未见将其用于催化α-羟基酮的不对称还原胺化制备手性氨基醇的研究报道。
通过对野生型亮氨酸脱氢酶的分子改造,研究团队首次开发出对α-羟基酮底物具有胺化还原活力的胺脱氢酶,实现了一系列α-羟基酮底物的还原胺化,合成了光学纯的(S)-邻位氨基醇产物,对映体过量值ee均大于99%。利用所开发的胺脱氢酶,最终实现了(S)-2-氨基-1-己醇和抗结核病药物乙胺丁醇(Ethambutol)手性前体(S)-2-氨基-丁醇的酶法制备,证明了胺脱氢酶催化合成手性氨基醇的可行性。近年来,该团队在胺脱氢酶催化合成手性胺的研究中已经取得了一系列研究成果,如通过分子改造显著拓展了胺脱氢酶催化的底物范围(ACS Catal. 2018, 8, 2622−2628);利用自主开发的胺脱氢酶设计了高效合成手性胺的多酶级联反应新途径(J. Org. Chem. 2019, 84, 14987; ChemCatChem 2015, 7, 3838)。
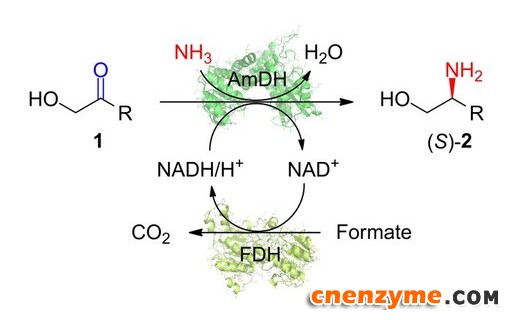
上述工作由陈飞飞博士在3位教授的共同指导下完成,并得到国家自然科学基金和中国留学基金等项目的资助。