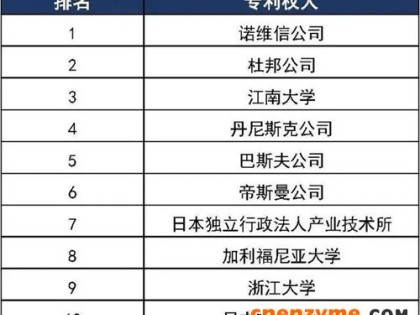
目前,印染助剂的研究发展方向是无毒性、低成本、高效、节能节水、易生化处理、缩短印染加工时间以及提高染色牢度。通过助剂的使用以符合人们环保意识提高的要求和保健的需要,由于国外标准的不断提高,促使了印染助剂的发展。
酶制剂是一种蛋白质,它是生物催化剂,因其结构及立体构型的独特性而具有反应专一性的特点,具有高效、反应快、成本低、高质量等的优点。广泛用于食品、医学、农业、工业和洗涤中。在印染工业中使用酶制剂由退浆逐步发展到纤维素和羊毛织物的抛光柔软、牛仔布的石磨、麻的脱胶、丝的精练、羊毛的防毡缩、纤维素纤维的煮练、漂白和浮色的去除、防沾污洗涤等等,其应用范围日益扩大,受到印染业界的青睐。本文对酶制剂国内外研发情况作了介绍。
1酶制剂发展为印染工艺的改革创造了条件
酶制剂与化学药剂进行印染加工的区别:⑴酶制剂反应的专一性,只能对特定的一种物质进行水解、裂解或特定的化学反应,从某些物质中去除某一种特定成分。例如用蛋白酶进行蚕丝的脱胶,能使丝胶水解,而丝素不水解,虽然丝胶和丝素都是蛋白质,但蛋白酶脱胶时不会损伤丝素;⑵可以在常温压下和弱酸弱碱介质中使用,对设备要求低,不会损坏设备,劳动条件较好;⑶酶制剂的生物催化反应速度快,可以从事快速反应。比如,退浆可以通过数十秒汽蒸来完成,这主要是因为酶制剂的催化活化能极低,催化效率比化学催化剂快得多。例如,过氧化氢的分解,在没有催化剂存在时,其活化能约75360.4J/mol,若在钯催化剂存在下,其活化能48985.6J/mol,降低了近一半,但用酶作催化剂时,其活化能7117.6J/mol,仅为无催化剂的过氧化氢活化能的1/10左右,反应速度大大加快,快十亿倍之多。由如1gα-淀粉酶晶体可在65℃、15min内将2t淀粉转化为糊状,若用酸将淀粉水解成糊状,则要在 140~150℃条件下进行。⑷酶本身是蛋白质,无毒,对酸碱和温度敏感,因此,可利用pH调节或温度来抑制酶制剂的反应;⑸酶的来源很广,动物、植物和微生物都可用作酶的原料,特别是微生物,不受季节、地域和气候的限制,而且微生物品种多,容易培养,繁殖较快,产量又高,可以在短时间内廉价地大量生产。尤其最近使用基因工程进行DNA顺序重组和编排,使酶的性能能按人们的需要而生产出新颖的酶制剂,使酶制剂发生突破性的进展;⑹酶制剂的生物催化反应速度快,一般能在50~60℃反应,可大量节约能源;⑺用防沾污洗涤剂染色物,在洗涤中的色度极高,而用酶洗涤其洗液色度较低,酶本身易生物降解,为环保型助剂。
在20世纪90年代,氧化还原酶(以过氧化氢酶、漆酶和过氧化物酶为代表)、裂解酶以果胶酶中特殊的果胶酸裂解酶为代表)加入到纺织工业应用领域中,近20年来,各类新型纺织用酶制剂的增长非常显著:老品种有新的应用;市场上出现了完全崭新的酶制剂,并且发展了新的应用领域;近几年来,新专利的数量大增,酶对天然纤维的应用工艺基础已经基本确立,而下一个里程碑将是针对和成纤维及其纺织品,对PVA的分解也是工作的目标。在这种情况下,印染工作者要密切关注酶制剂的发展,了解和熟悉新品种的使用,还要学习有关酶生物化学,以便使用好的酶制剂来提高印染成品质量和降低印染加工成本。
2酶的作用原理
酶是活细胞所产生的生物催化剂,生物体内的新陈代谢是在酶的参与下发生化学变化的,没有酶就没有生物的新陈代谢,也就没有生命活动。现在从生物界发现的酶已超过2500多种,工业上大量生产的酶有数十种。
2.1酶蛋白的结构
酶蛋白具有一般蛋白质的物理化学性质,由20种天然氨基酸构成的生物大分子化合物,是由氨基酸以肽健(酰胺健)聚合成的肽链,一个蛋白质分子可能由一条肽链构成,也可能由几条肽链构成。在蛋白质肽链上的氨基酸残基按严格确定的顺序排列,它的侧链可以是各种天然氨基酸,不是单一氨基酸残基的重复。
酶蛋白是球蛋白,具有一级、二级、三级甚至四级结构:一级结构,是指线性排列顺序的蛋白质;二级结构,是指肽链出现α-螺旋结构和β-折叠结构的形式,这是因为肽键上氢原子与另一肽键上的氧原子形成氢键所致;三级结构,是指蛋白质的肽链按严格的立体结构盘曲折叠,而成为完整的一个分子;四级结构,是指几条肽链组成的酶分子以非共价键结合的方式、按一定形式相互结合而成为完整的分子,其中每条完整的肽链称之为亚基。酶单百可以以一种亚基构成,也可以由几种亚基构成,亚基的数目位2~60个,四级结构具有催化活性。
酶分子这种精细和复杂的结构决定了酶的一些独特的性质,使它具有极高的催化效率和高度的专一性,它极易受外界环境的影响,如温度、pH、重金属离子的作用,改变酶蛋白的立体构型,使之变形或破坏,从而使酶丧失活力。新颖的酶制剂通过DNA编排顺序的改变,使酶的结构不易受外界环境的影响而变形,保持良好的活性中心。
2.2酶蛋白的活性中心
酶蛋白与一般蛋白质的不同之处在于酶蛋白具有活性中心。酶蛋白的活性中心是与底物发生催化作用的部位,由酶蛋白的立体构型所决定,一般是三级结构及四级结构才具有活性中心。若这种结构被破坏,活性中心也就破坏,酶就失去活性,这就是当环境变化时,酶丧失活性的原因。
整个酶蛋白,包括活性中心和非活性中心部分,都对酶的整体结构起着维持作用,决定了酶的亲水性强弱、整个分子的电性和电荷分布,以及活性中心周围的环境,如Ph、温度等等,这就决定了酶使用的最佳工艺条件。因此,改变酶蛋白中氨基酸或其排列顺序,就会改变酶的活性中心及其性质和效能。由于探索了其内在关系,便能人为地对酶进行改性,以满足工艺的需要。这便是新颖酶制剂所以能飞速发展的原因。
酶蛋白的活性中心是决定酶催化反应专一性的根本原因。酶催化反应的专一性实际上包括两方面内容:⑴与底物结合的专一性,决定酶的催化作用专一性;⑵对底物催化的专一性,分别由结合与催化部位组成构成活性中心,决定催化活力和催化专一性。
如前所述,酶的活性中心是由肽链中的某些氨基酸基团组成,催化部位的氨基酸数目一般只有2~3个,而结合部位的氨基酸数目要多一些,甚至处于不同的肽链上。
2.3酶催化作用机理
酶是催化剂,在催化反应过程中,酶并不消耗,而是在催化过程中,酶和底物生成络合物,在反应完成后,恢复到原来的酶。酶活性中心的结合部位首先决定了酶催化作用的专一性。因此,有人将它比喻为锁和钥匙的关系,提出了"锁和钥匙"模型,指出,酶蛋白的活性部位与底物的形状和大小完全适合时,才能发生催化反应,否则不会发生催化反应,但这模式过于机械化,因酶和底物都不可能是刚性的。试验证明在反应过程中酶和底物分子的结构在一定程度上会发生改变以适应其相互结合,只要形成三点结合就可以发生催化反应,但其催化机理至今不能用单一的机理解释,有的使底物中某一键发生水解断裂,例如酯的水解,先形成酰中间产物,最后再形成酸,有的催化分解是发生双键的裂解,有的是酶分子使底物氧化或还原,它作为电子的供体或受体。因此,催化机理随酶分子与底物分子的不同而不同,即使同一底物也因使用酶制剂不同而反应机理各异。所以提出了诱导契合学说,且得到了X光衍射证明。在一个合适形状的底物存在时,酶分子活性中心中的催化基团A和B排列在一起,在这种情况下便能发生催化反应,非底物分子虽能与C基团结合,但不能使A、B基团结合,发挥其催化反应,这样的非底物便成了竞争性抑制剂。
3酶制剂技术的近代发展
3.1第一代酶制剂是从动物、植物组织中提取的,而现在工业上应用的酶,主要来自微生物,因为微生物种类多,所有的酶几乎都能从微生物中找到,而且微生物易于培养,只要有简单的设备和一般原料为培养基,就能迅速繁殖,获得大量的酶。
3.2第二代酶制剂是通过基团工程方法生产的。它是将生产有效酶的微生物基团、重组成生产性高的其他微生物基团,进行高效酶的生产。
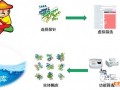
DNA重组菌是将编号的目的酶基团进行单体分离(纯株培养)得到的,这种基本操作如图2所示。
首先,用制限酶分解而产生目的酶的染色体,再将它和称为媒体的基团运输体结合,形成DNA重组媒体,接着将它引入寄生性细菌内,用细菌杂交等方法,选择进入目标。基团的DNA重组菌,DNA重组菌是多数DNA在菌体内重组,使媒体扩大,生产大量基团产物(酶)。寄生菌主要使用枯草菌和曲菌。
3.3第三带酶制剂是基团重组和蛋白质工程相组合的酶制剂,它是将酶蛋白的部分氨基酸置换为其它氨基酸的变换方法,可以改变酶的耐药性和耐热性等特性。这种基团重组与蛋白质重组的酶制剂在近几年的专利中几乎普遍使用,从而可获得染整加工所需要的酶制剂,其性能得到很大改进。例如混配在家用洗涤剂中的碱性蛋白酶,将酶分子中的一种蛋氨酸更换为丙氨酸,可以使这种酶对漂白剂具有耐久稳定性,而原来是不耐漂的,这正是当前急于需要解决的一个难题。
由于使用基团重组技术和将部分酶蛋白置换为其他氨基酸的蛋白质工程技术,使酶的性质得到改善。近年来,由于基团操作技术的进步,80%以上的工业用酶都是用DNA重组菌生产的。例如退浆用的α淀粉酶,过去是第一代产品,如BF7658酶,后来发展为70℃的中温型酶和90℃高温型酶(第二代产品),几年前,通过基团重组,生产了能在所有温度范围内使用的酶,是又基团重组的芽孢杆菌属微生物培养出来的,在70℃溶液中其酶活力为原中温型酶的4.5,还能在高温区使用,具有良好的耐热性,若用汽蒸法退浆,能在数十秒钟内完全退浆任务。
为了扩大酶的使用价值,人们早就研究酶的固定技术,目前固定化技术也不断改进,与基团工程、蛋白质工程相配合,给工业生产带来了很大益处。但还没有找到普遍适用的固定化方法和廉价的载体。目前通过固定化已有可能将多种固定化酶装在同一个柱中进行多酶反应:淀粉酶、糖画酶、异构酶同柱顺序反应将淀粉转化为果糖;或将糖酵解的酶全部制成固定化酶,能将葡萄精直接生产酒精;α-淀粉酶、果胶酶、脂肪酶固定在同一柱中,对上浆的棉坯布直接进行退浆、煮练,如果再加上漆酶与过氧化酶,则可1次性完成棉的前处理过程,总过程只要3h,还有人大胆设想,通过基团重组、蛋白质工程的置换氨基酸以及DNA编号顺序的重新排列,可以在同一个酶分子中装备不同的活性中心,每种活性中心发生1种催化反应,这种酶就可以完成多种酶的作用,这将为染整工业的革命奠定基础。
固定化酶就是将酶通过化学或物理手段,将酶束缚在一定区见内,限制酶分子在此区间内进行活跃的催化作用。所以固定化酶就是束缚其在一定空间的酶。固定化酶活性中心的氨基酸残基不发生变化,而固定化酶可以提高酶的催化效率和稳定性,使用方便,酶反应易于调节和控制。并且可提高酶催化反应生成物的纯度和得率,还可以节能,固定化:方法吸附法,将酶吸附在吸附剂上;共价结合法,将酶蛋白上的基团通过共价结合连接到载体上;交联法,用交联剂将酶蛋白分子进行交联;包埋法,将酶物理性的包埋在高聚物内。