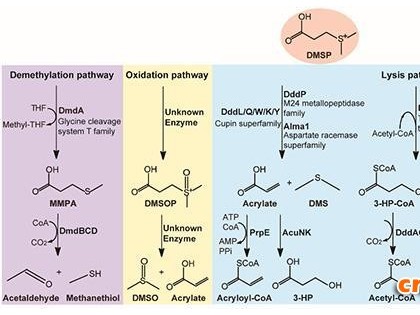
采用生物路线来合成化学物质承担着未来化学物质生产的重任,对于一些利用不可再生能源生产的或难以采用传统合成方法生产的化学物质而言尤其如此。合成化学物质比较普遍的策略是利用一种基于活细胞合成潜力的代谢工程途径,但是这种方法常常会遇到瓶颈,其中包括有用的代谢产物流失,以及有毒中间产物的堆积。在这个问题上,加州大学伯克利分校Dueber等人在2009年第8期《Nature biotechnology》上发表的研究表明,利用人工合成的支架蛋白能够募集代谢酶类,可以极大地提高甲羟戊酸(类异戊二烯前体如抗疟疾药物青蒿素)的产量,同时降低整体细胞的代谢负荷。这项研究首次在微生物体内利用定向的组装酶复合物,从而对化学物质的合成进行了优化,并为现有的代谢工程技术提供了补充。
自然界为共位酶的催化反应及相应底物反应途径设计了完美的策略。这些策略包括促进酶活性位点实现物理结合(色氨酸合成酶和氨基甲酰磷酸合成酶的结合)的共位酶生成保护渠道以及使底物实现与复合酶模块(通过蛋白质的相互作用聚合起来)共价连接,并沿模块依次移动的底物组装线(聚酮合成酶)。然而到目前为止,很少在微生物工程中利用这种酶的组装来提高多步的代谢反应。这种设想仅仅局限于融合蛋白,其结果也有好有坏。一个成功的案例是,实验室在改进生产甘油的高产大肠杆菌菌株(Escherichia coli)时,意外发现编码甘油三磷脱氢酶1 (GPD1)和甘油三磷酶2(GPP2)的基因之间发生了重组,结果产生了兼具甘油三磷脱氢酶1和甘油三磷酶2活性的融合蛋白。然而,研究人员显然需要探讨简单的融合蛋白以外的其他办法,并制定计划以更好的模仿那些在自然界中发现的顺序酶反应的空间组织设计。
Dueber等人通过建立稳固的细胞内支架,从而使进行连续酶促反应的酶能够通过小肽配体能够成功对接。这些细胞内支架包含一系列由多细胞动物的基因组编码的高度特异性的模块化对接区域:GTP酶结合域(GBD)来自控制肌动蛋白聚合的NWASP,SH3结合域来自CRK蛋白,PDZ的结合域则来自互生蛋白。甲羟戊酸生产过程中的三种酶——大肠杆菌AtoB、酿酒酵母HMGS和HMGR,通过配体与对接区域的特异性的结合,从而实现在细胞内骨架上的定位。
这项酶组装策略的优点是,它仅需要对靶向酶稍做修改,而不需要酶的结构信息,类似于亲和纯化额外的融合标记。Dueber等研究表明,由非共价方式将酶与合成的细胞内支架结合,与不使用支架途径相比甲羟戊酸的产量可能增加了近77倍,这些依赖于相互作用结构域的重复数和结构域在支架上的位置。这种支架的设计意味着技术发展水平相当大的进步,因为它能够使两个或两个以上酶系统中实现多种酶的组合和酶的位置。该策略能够同时从空间和化学计量上配置多个酶的能力非常重要,因为它能平衡整个反应通路的反应速率。
令人兴奋的是,这种支架还能够促进结构上无关化合物——葡萄糖的生产,研究表明,这种做法还能够延伸到用于其他代谢途径。但是,在制定其他合成支架系统中仍有几个重要问题需要考虑。首先,许多代谢酶实际上都是多聚体,如果酶的亚基被支架结构整个或部分覆盖,可能会造成多种后果。同样,能否成功的用配体来标记酶主要取决于蛋白结构,所以更彻底的寻找肽插入位点可能有必要。还需要进一步完善支架配体相互作用,从而能够确保支架组装更"干净",并防止大量的无酶的支架或无支架的酶的积累。
应当指出的是,新陈代谢途径的概念并非没有争议,因为对其影响的直接测量还被实验证据所困扰。Dueber等人推测,酶是通过提高中介代谢物的有效浓度来提高酶促反应的效率。然而,也有其他可能的机制有助于增加甲羟戊酸产物的产量,包括改善酶的折叠,减少酶的聚集或退化,或这些措施的结合。最后,即使这种途径的效应是真实的,也仅可能在对酶通量经过仔细平衡的高度工程化的系统中有效,对酶通量的平衡时是基于这种酶在生产葡萄糖酸没有生产甲醛戊酸有效的发现进行的。不管怎样,使用合成酶支架明显提高了代谢性能,并提供了一个能够与传统方法,比如通过调节基因间隔区域或调节限速酶从而调节酶的表达水平,同时使用的强大的新方法。在长远来看,同时整合的这几种策略来平衡酶促反应,消除代谢障碍,减少细胞斜坡,防止非必要的中间产物或副产品的积累是很有可能的,这势必会为各种代谢产物,如生物燃料、特种化学品和新的疾病治疗方法,在各个水平上进行的商业化生产扫清障碍。
上海生命科学信息中心 编译自
https://www.nature.com/nbt/journal/v27/n8/full/nbt0809-728.html