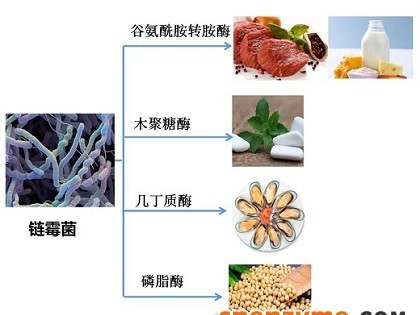
一、溶菌酶历史
溶菌酶是由英国细菌学家费明(Fenin)于1929年在鼻粘液中发现的强力杀菌物质,随后命名为溶菌酶。
二、溶菌酶定义
溶菌酶(Lysozyme)又称胞壁质酶或糖苷水解酶或N-乙酰胞壁质聚糖水解酶,是一种专门作用于微生物细胞壁的水解酶。由129个安基酶组成碱性球蛋白,为白色或微黄色的结晶性或无定形粉末;无毒、无臭、味甜、极易溶于水,不溶于丙酮、乙醚、乙醇。是一种碱性球蛋白,对PH变化较稳定,酸性条件下对热稳定的蛋白质,在鸡蛋蛋清中含量最丰富。
溶菌酶广泛存在于鸟类和家禽的蛋清。哺乳动物的泪、唾液、血液、尿、乳汁白细胞中及其体液(如淋巴液)和组织(如肝、肾)的细胞内,其中以蛋清中含量最为丰富约0.3~0.5%。我国幅员辽阔,蛋源丰富,具有较大的发展前途。
三、溶菌酶分类
随着研究的不断深入,人们发现溶菌酶不仅对细菌细胞壁有作用,还可作用于真菌细胞壁。根据来源不同,溶菌酶可以分为以下三类:
1)动物溶菌酶
鸡蛋白中约含有3.5%的溶菌酶,可分解革兰氏阳性菌,对革兰氏阴性菌不起作用,其分子量为14000。此外,从其他鸟类蛋白、哺乳动物乳汁及体液中也分离到了溶菌酶。
2)植物溶菌酶
研究人员对116科410种植物进行普查,发现168种植物中含有溶菌酶。其中木瓜、无花果,大麦等植物中均可分离出溶菌酶,其分子量较大,约为24000-29000,其对溶壁小球菌的溶菌活性不超过鸡蛋白溶菌酶的1/3。
3)微生物溶菌酶
人们从上世纪60年代发现微生物也产生溶菌酶,按其作用对象可分为两大类,即细菌溶菌酶和真菌溶菌酶。
♦细菌溶菌酶
细菌溶菌酶通常可分为三大类:N-乙酰氨基己糖苷酶,它催化水解肽聚糖中糖骨架中的β(1→4)糖苷键;N-乙酰胞壁酰-丙氨酸酰胺酶,它催化裂解肽聚糖中糖基与肽基;内肽酶,它催化裂解肽聚糖肽桥中的肽键。研究发现,溶菌酶的抗菌活性不仅表现在其分解细菌细胞壁方面,当酶受到不可逆抑制后,它仍然显示出抗菌效应,这可能与溶菌酶呈碱性有关。不同来源的溶菌酶有不同的抗菌范围,并对不同类型的肽聚糖有特异性,特别是它们对O-乙酰化肽聚糖的分解能力不同。由于革兰氏阳性菌无外膜,所以溶菌酶对它们作用较强。溶菌酶与EDTA并用,可加强对革兰氏阴性菌的抑制作用。用紫苏醛处理溶菌酶,或将溶菌酶连接到半乳甘露聚糖上,可加强该酶穿过外膜进入靶细胞,从而增强其对革兰氏阴性菌的作用。此外,溶菌酶与其他抗微生物酶(葡萄糖氧化酶、乳过氧化物酶)或与传统的防腐措施(如山梨酸盐、乙醇、温度和低PH)联用,可以提高食品微生物安全性。
♦真菌溶菌酶
真菌溶菌酶主要包括几丁质酶和-β葡聚糖酶。
♦♦几丁质酶
虽然一些外几丁质酶(exochitinases;EC3.2.1.30)也表现出抗真菌的特性,但抗真菌的几丁质酶主要是内几丁质酶(endochitinases;EC3.2.1.14)。人们已经研究了许多来自于植物和微生物的几丁质酶,并对有些几丁质酶抑制真菌生长/裂解真菌细胞的作用进行了研究。科学家们首先在植物中发现了几丁质酶的抗真菌作用,这类几丁质酶可以对抗侵入植物体的真菌病原体。微生物几丁质酶主要是由链霉菌属、杆菌和大多数真菌产生的。细菌分泌几丁质酶主要用于真菌细胞壁的降解和重组,但在大多数产几丁质酶的真菌中,此酶主要用于真菌细胞壁的成型过程。只有在一些特定的寄生霉菌中,如 Trichoderma harzianum、APhanocladium album和Gliocladium vixens中,胞外几丁质酶和β-葡聚糖酶用来附着和降解目的菌丝。这些抗真菌的几丁质酶与植物几丁质酶相似,多为内几丁质酶。由于肽聚糖和甲壳质的糖骨架具有相似的结构,因此,一些几丁质酶也具有溶菌酶活性。
♦♦β-葡聚糖酶
β-葡聚糖酶(β-glucanases;EC 3.2.1.39)具有抗真菌作用主要是因为它能水解β(1→3)糖苷键。研究表明:β(1→3)葡聚糖酶对几丁质降解真菌细胞壁具有显著的协同作用。如将纯化的几丁质酶和β-葡聚糖酶合用,抗灰色葡萄孢(Botrytis cinera)的作用提高了10倍。内葡聚糖酶与外葡聚糖酶、不同内葡聚糖酶间也具有协同抗真菌作用。因为许多植物性食品中含有β-葡聚糖成分,它对维持产品的组织性、黏度和外观都有重要作用,将β-葡聚糖酶加入这类食品,可能会引起不良影响。真菌的细胞壁主要组分为几丁质和β-葡聚糖,但一些真菌和大多数酵母细胞壁含有其他类型的多糖(甘露聚糖、α-葡聚糖和纤维素),因此,甘露聚糖酶、α-葡聚糖酶也可作为抗真菌的酶类应用于食品工业。