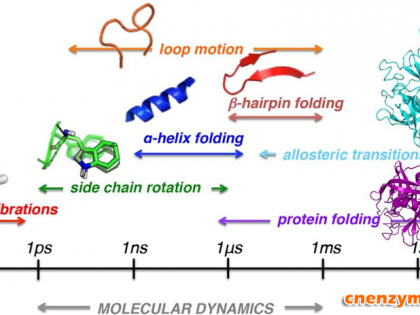
酶是一种由活细胞产生的生物催化剂,其本质是蛋白质,在生物的新陈代谢中起着非常重要的作用,它参与生物体几乎所有的化学反应,使新陈代谢有序的进行下去,从而使生命得以延续。
1、酶的分类:
1961年,国际生物化学联合会把酶分为六大类:
氧化还原酶类: AH2+B A+BH2(催化底物时进行了电子反应)
转移酶类:A-R+B A+B-R(一种分子上的基团转移到另一种分子上)
水解酶类:A-B+HOH AOH+BH(催化大分子加水分解成小分子)
裂解酶类: A-B A+B(催化一个化合物为几个化合物)
异构酶类: A B(底物分子内重排反应)
合成酶类: A+B+ATP AB+ADP( 腺苷二磷酸)
目前工业中所使用的酶制剂绝大部分属于水解酶类。
2、酶的活力定义:
酶的活力由多种定义方式,常用的有以下两种:
2.1、在一定的条件下(温度、PH),单位时间内催化转化一定量的底物生成特定产物所需的酶量;
当测定酶系活力时,如果在特定条件下,采用每1分钟催化1μmol的底物转化为产物的酶量的表达形式时,该酶活力值即为国际单位(IU)。
2.2、在一定的条件下(温度、PH),单位时间内催化转化一定浓度的底物生成一定量特定产物所需的酶量。这种方式是较为常用的。
3、酶的特性:
3.1、高效性:酶的催化反应可以在常温常压和温和的酸碱条件下进行,一个酶分子在一分钟内能引起数百万个底物分子转化为产物,较其他催化剂相比,酶的催化能力大1000万倍到10万亿倍。
3.2、绝对或相对的专一性:酶促反应的另一个特点就是对底物的高度专一性。一种酶只能催化一种(绝对专一性)或一类物质(相对专一性)反应,即酶是一种仅能催化特定化合物、特定化学键、特定化学变化的生物催化剂。
3.3、酶的化学本质:酶之所以不同于一般催化剂的特性,主要是酶的化学本质以及结构所致。酶的化学本质是蛋白质,具有蛋白质所具有的一切特性。(如:两性电解质,紫外线、热、重金属、酸碱等使其变性,被蛋白酶分解等)
4、酶的结构和催化机制:
4.1、酶的组成与结构:
酶的化学本质是蛋白质,蛋白质分子是由氨基酸组成。酶的结构分为四级:
一级结构:氨基酸残基严格地按一定顺序线性排列称为蛋白质一级结构,一个蛋白质分子可能由一条肽链构成、也可能由几条肽链构成。
二级结构:由于肽链上的一个肽键上的氢原子与另一个肽键上的氧原子有可能能形成氢键,所以,肽链可以出现α-螺旋和β-折叠两种稳定的构象形式,这称为蛋白质二级结构。
三级结构:完整的蛋白质分子的肽链在空间的排列中按照严格的立体结构盘曲折叠而成一个完整的分子,这种立体构象称为蛋白质三级结构。
四级结构:由几条肽链所组成的酶分子,以非共价键的方式按一定的形式相互结合成为完整分子的方式称为蛋白质四级结构。其中每条完整的肽链称为一个亚基。
4.2、酶的活性中心:酶蛋白与其他蛋白质不同之处在于酶蛋白有活性中心。所谓活性中心是指酶蛋白上具有的与催化活性有关的一个特定区域,其中包括催化过程中关键的催化基团以及与底物结合有关的结合基团。
5、酶的催化机制:
5.1、酶与底物的结合:
酶促化学反应中的反应物称为底物,一个酶分子在一分钟内能引起数百万个底物分子转化为产物,酶在反应过程中并不消耗。但是酶实际上是参与反应的,只是在一个反应完成后,酶分子本身立即恢复原状,又能进行下一次反应。许多实验证明,酶和底物在反应过程中形成络合物。
5.2、酶的作用机制:
对于酶的催化作用机制,目前较为认可的有两种理论假说:一个是“锁钥”模式(1890 Fisher提出),酶与底物的结合有很强的专一性,也就是对底物具有严格的选择性,即底物分子结构稍有变化,酶也不能将其转化成产物;另一个是“诱导契合学说”(Koshland提出),“诱导契合学说”认为催化部位要诱导才能形成,而不是现成的。
5.3、酶的结构与催化功能的关系
酶的一级结构是酶具有催化功能的决定性部分,而高级结构为酶催化功能所必须部分。酶的一级结构发生变化,其催化功能发生相应的改变。酶的二级、三级结构是所有酶都必须具备的空间结构,是维持酶的活性部位所必须的构型。当酶蛋白的二级、三级结构彻底改变时,就可使酶遭受破坏而丧失其催化功能。
具有四级结构的酶,按其功能可分为两类:一类与催化作用有关,另一类与代谢调节密切相关,只与催化作用有关的具有四级结构的酶由几个亚基组成,每个亚基都有一个活性中心,只有在四级结构完整时,催化功能才会发挥出来;只与代谢调节作用有关的具有四级结构的酶,其组成亚基中,部分亚基具有调节中心,调节中心可分为激活中心和抑制中心,使酶的活性受到激活或抑制,从而调节反应速度和代谢过程。
5.4、酶促反应动力学理论
酶促反应过程: E+S ES—E+P
E—酶
P—转化物
米氏方程(Michael—Menten): u=v[S]/Km+[S]
u—反应速度
v—底物饱和时的最大反应速度
[V]—底物浓度
Km—米氏常数
米氏方程给出了酶反应速度与底物浓度之间的定量关系。
从米氏方程可以得出:在底物浓度低时,酶分子的活性中心未被底物饱和,于是反应速度随底物的浓度而变,当底物分子的数目增加时,酶活性中心更多地被底物分子结合直至饱和,就不再有活性中心可以发挥作用了,这时酶充分发挥了效率,反应速度不再取决于底物浓度了。