用对氨基苯磺酸染色酪蛋白制备成为偶氮酪蛋白,染色过程是经严格控制的,其灵敏度是其它产品的5倍(如:Sigma Chemical Co., Azo-CaseinLot. 74H7165)。
溶解:
将粉末状的底物(2 g)放入120 ml烧杯中,加入4 ml乙醇或工业甲基化酒精(IMS),用磁力搅拌器充分混合,打碎所有的块状底物,然后加入96 ml磷酸钠缓冲液(100 mM, pH 7.0;Buffer A),再次充分搅拌直到底物全部溶解(大约10分钟),可用玻璃棒驱散任何粘住烧杯边缘的偶氮酪蛋白,溶解完全的溶液保存于可密封的容器中,加入2滴甲苯以防止微生物的污染,4°C下保存,可以保存数周。
应用:
偶氮酪蛋白可以用于测定所有内切-蛋白酶对于酪蛋白的酶活,如细菌碱性蛋白酶(e.g. Subtillisin A, as in Alcalase from Novo Nordisk)、木瓜蛋白酶、胰蛋白酶、真菌性和细菌性蛋白酶以及菠萝蛋白酶。此说明书中提供了枯草杆菌蛋白酶A、胰蛋白酶和糜蛋白酶的标准曲线,对于其他的蛋白酶,提供有计算用的回归方程式,偶氮酪蛋白测定蛋白酶酶活的灵敏度低于蛋白酶AK测试药片的灵敏度(大约20-50%)。
标准曲线适合于在pH 7.0下制作,对于在更广泛的pH和温度等条件下,使用内切蛋白酶制作标准曲线,并不是每一种情况下都能产生标准曲线,对于特定需求,您可以直接联系我们。
提取、稀释和试验用的缓冲液:
BUFFER A: (磷酸钠, 100 mM, pH 7)
用900 mL蒸馏水溶解17.8 g二水磷酸氢二钠(Na2HPO4•2H2O),并用1 M氢氧化钠(40 g/L)调节pH到7.0,然后将体积调整到1L,4°C下保存,可加入叠氮化钠(0.2 g; Sigma S-2002)作为防腐剂使用。
BUFFER B: (磷酸钠, 100 mM, pH 7),半胱氨酸(30 mM)和EDTA (30 mM)
用450 mL蒸馏水溶解8.9 g二水磷酸氢二钠(Na2HPO4•2H2O)、一水L-盐酸半胱氨酸(2.65 g; Sigma C-7880)和乙二胺四乙酸(5.6 g, EDTA; Sigma ED2SS),并用1 M氢氧化钠(40 g/L)调节pH到7.0,然后将体积调整到500 m L,4°C下保存,2天内使用完。
注意:
对于硫羟基蛋白酶(如:木瓜蛋白酶、菠萝蛋白酶和无花果蛋白酶)需要使用Buffer B进行提取和稀释,对于其他蛋白酶可以使用Buffer A
酶的提取和稀释:
1.0 g粉末状酶制剂加入50 mL的Buffer A或B,在室温中用磁力搅拌器充分搅拌15分钟(直到粉末全部溶解或驱散),如有必要可以过滤或离心(1,000g),此溶液即为最初提取液,还需要进一步对提取液进行稀释(1 mL+9 mL of Buffer A or B)直到适合于试验要求的浓度。
1.0 mL液体酶制剂加入49 mL的Buffer A或B,并充分搅拌混匀,如有必要可以过滤或离心(1,000g),此溶液即为最初提取液,还需要进一步对提取液进行稀释(1 mL+9 mL of Buffer A or B)直到适合于试验要求的浓度。(Alcalase蛋白酶大约需要100倍稀释)
实验步骤:
1. 1.0 ml 已经处理好的酶溶液[用Buffer A或B(pH 7.0)]加入1.0 ml已经用Buffer A处理好的底物
2. 用漩涡混合器充分混合并在40°C下孵育10分钟
3. 加入5%的三氯醋酸(TCA, 6.0 ml),用漩涡混合器充分混合5秒钟,未水解的偶氮酪蛋白被沉淀,反应结
4. 将反应管置于室温下,平衡5分钟,然后用Whatman No.1 (9 cm)滤纸过滤,或者在3,000 rpm (1,000g)下离心10分钟
5. 相对于空白对照在440 nm 下测定反应管的吸光度值
标准曲线:
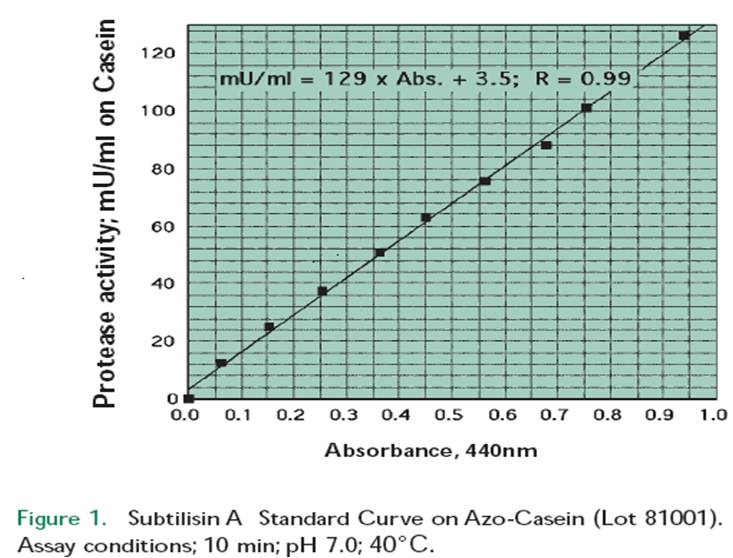
图1-3表示的是在pH 7.0和40°C条件下,枯草杆菌蛋白酶A、胰蛋白酶和糜蛋白酶与偶氮酪蛋白(Lot 81001; absorbance 440 nm)反应,所测得的蛋白酶相对与酪蛋白(pH 7.0和40°C)的酶活标准曲线,对于枯草杆菌蛋白酶A所呈现的是直线相关性曲线,然而,对于胰蛋白酶和糜蛋白酶显然就是非直线性曲线,以下列出了其他各种蛋白酶的回归方程式,枯草杆菌蛋白酶A、胰蛋白酶和糜蛋白酶的计算方程式与此类似,木瓜蛋白酶和菠萝蛋白酶的斜率非常大,可能是由于提取液中高含量的肽酶在酪蛋白试验中一同被测量了,但是在偶氮蛋白酶试验中没有被测定所导致的,关于蛋白酶的进一步研究正在进行之中。
木瓜蛋白酶(from Papaya latex):
蛋白酶 (milli-Units/mL) = 270 x Abs. (440 nm) + 7; R = 0.99
线性吸光度范围 = 0.1-1.0
菠萝蛋白酶(from pineapple stem):
蛋白酶(milli-Units/mL) = 460 x Abs. (440 nm) - 13; R = 0.99
线性吸光度范围= 0.1-0.9
无花果蛋白酶(from figs):
蛋白酶(milli-Units/mL) = 190 x Abs. (440 nm) + 3; R = 0.99
线性吸光度范围= 0.1-1.1
枯草杆菌蛋白酶A (from Bacillus licheniformis):
蛋白酶(milli-Units/mL) = 129 x Abs. (440 nm) + 4; R = 0.99
线性吸光度范围= 0.1-1.0
细菌性蛋白酶 (from Bacillus subtilis):
Protease (milli-Units/mL) = 250 x Abs. (440 nm) -8; R = 0.99
线性吸光度范围= 0.1- 1.0
蛋白酶 K (from Tritirachium album):
蛋白酶(milli-Units/mL) =140 x Abs. (440 nm) - 4; R = 0.99
线性吸光度范围= 0.1-1.0
真菌性蛋白酶(A. niger; from Sigma Chemical Co.):
蛋白酶(milli-Units/mL) = 146 x Abs. (440 nm) - 4; R = 0.99
线性吸光度范围= 0.1-1.0
1个蛋白酶活单位被定义为:单位时间内,在标准实验条件下(pH 7.0;40°C),将可溶性酪蛋白水解成1微摩尔酪氨酸所需要酶的数量。


