五、实验步骤
(一)酶的制备
1、粗酶液的提取
将圆葱切至3cm左右见方的小块,放入高速组织捣拌机中,捣碎3-5分钟,以0.5倍的0.5mmol/LNaCl于4℃下浸泡过夜。然后5000转/分钟冷冻离心,20分钟,弃去沉淀,留取上清液,即为SOD抽提液.留样5ml测定其酶活和蛋白质含量。注意:冷冻离心瓶相对位置应配平。
2、热变性
将粗酶液在55℃下进行处理30分钟,然后高速冷冻离心,5000转/分钟,20分钟,弃去沉淀,留取上清液,留样5ml测定其酶活和蛋白质含量。
3、丙酮分级沉淀
取经热击处理后的上清液,缓慢加入冷丙酮量为0.4V/V,然后在冰浴条件下搅拌,冰浴2小时。5000转/分钟高速冷冻离心,20分钟,弃去上清夜,沉淀用5倍2.5mmol/L的磷酸缓冲溶液溶解,留样2ml测定其酶活和蛋白质含量。(此时去除杂蛋白的效果最好。)
4、DEAE-纤维素柱层析
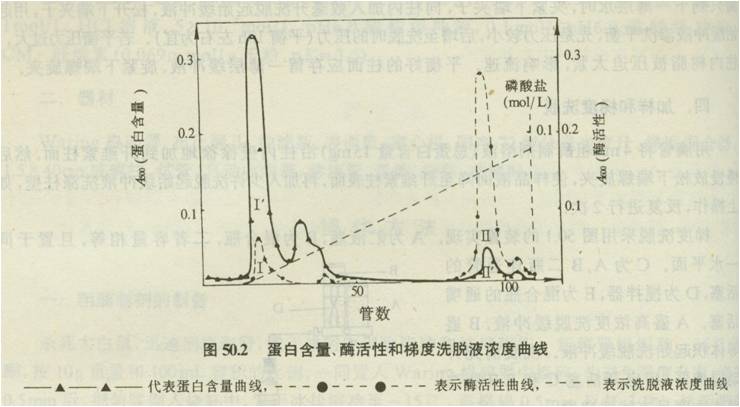
取经过丙酮沉淀后溶解的上清夜,稀释10倍,过DEAE-纤维素柱(2.6mm*40mm)。先用2.5mmol/LpH7.8磷酸缓冲溶液平衡3-4个床体积,上样量为1毫升,继续用2.5mmol/LPH7.8磷酸缓冲溶液冲洗120ml,然后再分别用2.5-250mmol/L, pH为7.8的磷酸缓冲液梯度洗脱,流速为0.6 ml/min,每5分钟收集一管。紫外监测波长280nm,然后收集有活性的部分,量取体积,测定蛋白质含量和酶活性。留取少量溶液备用。

(二) 酶活性的测定
2.1活性的测定
测定前在54ml14.5mmol/Ldl-甲硫氨酸中分别加入EDTA,NBT,核黄素溶液各2ml混匀,此为反应混合液。
在盛有3ml反应混合液的试管中,加入适量的酶液(以使抑制达50%左右的酶浓度为佳),混匀后放在透明的试管架上,于光照培养箱中准确照光30分钟,迅速测定560nm下的光密度,以不加酶液的照光管为对照,计算反应被抑制的百分比。或者按照表1加入试剂量进行添加。
表1
|
试剂
|
样管
|
最大光化管
|
对照管/ml
|
|
dl-甲硫氨酸
|
2.7
|
2.7
|
2.7
|
|
EDTA
|
0.1
|
0.1
|
0.1
|
|
核黄素
|
0.1
|
0.1
|
0.1
|
|
NBT
|
0.1
|
0.1
|
0.1
|
|
酶液
|
适量
|
---
|
---
|
2.2活力的计算
以能抑制反应50%的酶量为一个SOD酶活单位。其SOD活力可由下式计算
SOD活力(U/ml)=×100%=
(三) 蛋白质浓度测定——紫外线吸收法
3.1制备法标准曲线
按照下表分别在以下8个比色管中加入标准蛋白溶液、蒸馏水、不同蛋白质浓度的样品后,摇匀。选用光程为1cm的石英比色杯,在280nm波长处分别测定各管溶液的吸光值A280值,以A280 值为纵坐标,标准蛋白含量为横坐标,绘制标准曲线。取16支试管,分两组按下表平行操作。
表2
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
|
标准蛋白溶液/ml
|
0
|
0.5
|
1.0
|
1.5
|
2.0
|
2.5
|
3.0
|
4.0
|
|
蒸馏水/ml
|
4.0
|
3.5
|
3.0
|
2.5
|
2.0
|
1.5
|
1.0
|
0
|
|
蛋白质浓度(mg/ml)
|
0
|
0.15
|
0.25
|
0.375
|
0.5
|
0.625
|
0.75
|
1.0
|
|
A280
|
3.2样品蛋白质浓度测定
取待测蛋白质溶液1ml,加入3ml,摇匀,按上述方法在280nm波长处分别测定各管溶液的A280值,并从标准曲线上查出待测蛋白质的浓度。如果样液被稀释,则未知蛋白浓度按下列公式计算
蛋白质(g)/ml酶液=
六、结果
总活力和收率按下列公式计算,将结果添于表3。
总活力(U)= SOD活力×原液总体积
收率= ×100%
表3--SOD的分离纯化结果表
|
酶液体积(ml)
|
蛋白浓度(mg/m)
|
单位活力(U/ml)
|
总蛋白(mg)
|
总活力(U)
|
比活力(U /mg)
|
活性回收(%)
|
纯化倍数
|
|
|
粗酶液
|
||||||||
|
热击
|
||||||||
|
丙酮沉淀
|
||||||||
|
DEAE层析
|
七、思考题
1、超氧化物歧化酶对人体有何生理学意义?
2、有机溶剂能沉淀超氧化物歧化酶所根据的原理是什么?
3、离子交换纤维素有何特点?为什么人们常用它来分离纯化酶及其他生物活性大分子物质?
4、何为梯度洗脱法?它有何特点?
