范志恒
摘 要 根据动物的消化特点和选择的饲料原料,利用黑曲霉菌种进行固态发酵生产饲用复合酶,试验研究了使发酵产生的各项酶活力达到最高时,固态发酵培养基的最优组成及最佳发酵条件。结果表明:固体发酵培养基:麸皮64 g、豆粕粉5 g、(NH4)2SO4 1 g、稻壳 20 g、玉米芯粉10 g、营养因子C 0.4 g;最佳发酵条件:接种量0.3%、发酵培养温度30 ℃、发酵培养时间48 h。
关键词 固态发酵;复合酶;发酵条件
中图分类号 S816.3
目前,酶制剂有上千种,可用于饲料工业的有20多种。由于酶制剂能有效提高饲料利用率,节约饲料原料资源,消除抗营养因子,激活内源酶的分泌,且无毒副作用,不存在药物添加剂的药物残留和产生耐药性等不良影响,因而是一种绿色、环保的饲料添加剂,近些年来在饲料工业中得到了广泛应用。饲用复合酶制剂的生产,有采用单菌株液态深层发酵生产单酶,再通过各种单酶混合复配形成复合酶产品,此法生产全谱酶系产品生产成本也相对较高;而我国饲料工业总体附加值较低,饲料用酶无需精制,因此,除植酸酶的生产主要采用液态发酵外,饲用复合酶制剂的生产一般采用固态发酵。固体发酵法生产的饲用复合酶酶系全、酶谱广,具有较高的性价比;酶种间天然复合无拮抗有天然协同作用,发酵成熟曲料烘干后可直接使用,后道提取程序简洁,成本很低。并且固体发酵饲用复合酶生产过程中几乎没有废水、废渣排放,引起的环境污染问题少。
本文首先通过实验室试验研究了黑曲霉固体发酵生产复合酶的条件,通过对发酵培养基和发酵条件的优化,得到固体发酵的最佳条件。最后把得到的最佳发酵条件用于工业化生产,通过对生产一年的酶活数据统计,该复合酶酶系广、酶活高且稳定,其主要成分及酶活如下:木聚糖酶1 200 000 U/g、甘露聚糖酶11 000 U/g、β-葡聚糖酶520 000 U/g、果胶酶230 000 U/g、纤维素酶8 000 U/g、酸性蛋白酶 4 000 U/g、α-半乳糖苷酶5 000 U/g。
1 材料与方法
1.1 材料
1.1.1 菌种
本实验室保藏菌种黑曲霉菌株。
1.1.2 培养基
斜面培养基:PDA培养基[3]。
扩大种子培养基:麸皮、葡萄糖、无机盐,调pH值6.0。
发酵培养基:麸皮、豆粕粉、稻壳、玉米芯粉、无机盐、营养因子,调pH值6.0。
1.2 发酵培养方法
1.2.1 斜面菌种培养
将菌种用无菌接种环接种培养基斜面,置30 ℃培养4 d。
1.2.2 三角瓶试验
扩大种子培养:扩大种子培养基置三角瓶中高压灭菌后,接种经无菌水洗下的斜面种子,30 ℃培养4 d。
固体发酵培养:每100 g原料加入100 ml水,拌匀装入三角瓶中,于121 ℃高压蒸汽灭菌30 min,出锅冷却至30 ℃左右加入曲种,于30 ℃恒温培养箱中培养至20 h左右,若料温过高,可进行扣瓶1次,发酵2 d后即可取样测定。
1.2.3 生产试验
固体发酵培养:将发酵培养基料按照料水比1:0.8的比例拌匀后倒入蒸球中,于121 ℃高压蒸汽灭菌30 min,通冷水冷却至30 ℃。无菌操作从种子罐中输入种子液,在蒸球中拌匀。在无菌环境条件下将已接种的培养基输送入曲房,铺固体发酵床,通无菌空气控温控湿,培养至20 h左右,若料温过高,可进行翻曲1次,发酵2 d后即可取样测定。
1.3 分析测定方法
采用还原糖法(DNS)测定。
① 木聚糖酶:1 g酶粉于40 ℃、pH值5.0条件下,1 min水解木聚糖生成相当于1 μg木糖还原物质,即为1个酶活力单位,以U/g表示。
② 甘露聚糖酶:1 g酶粉于40 ℃、pH值5.0条件下,1 min水解角豆胶生成相当于1 μg甘露糖还原物质,即为1个酶活力单位,以U/g表示。
③ β-葡聚糖酶:1 g酶粉于40 ℃、pH值5.0条件下,1 min水解β-葡聚糖生成相当于1 μg葡萄糖还原物质,即为1个酶活力单位,以U/g表示。
④ 果胶酶:1 g酶粉于40 ℃、pH值5.0条件下,1 min水解果胶生成相当于1 μg半乳糖醛酸还原物质,即为1个酶活力单位,以U/g表示。
⑤ 纤维素酶:1 g酶粉于40 ℃、pH值4.8条件下,1 min水解CMC生成相当于1 μg葡萄糖还原物质,即为1个酶活力单位,以U/g表示。
⑥ α-半乳糖苷酶:1 g酶粉在40 ℃、pH值5.0条件下,每分钟从浓度为1.5 mg/ml的对硝基苯-β-葡萄糖苷溶液中降解释放1 μg对硝基苯酚所需要的酶量为一个葡萄糖苷酶活力单位,以U/g表示。
⑦ 酸性蛋白酶:1 g酶粉在40 ℃、pH值3.0条件下,1 min水解酪素产生1 μg酪氨酸为一个酶活力单位,以U/g表示。
2 结果与讨论
2.1 固体发酵培养基的筛选
2.1.1 碳源对酶活力的影响
以葡萄糖、麸皮作为供试碳源,测定各项酶活力,测定结果如表1所示。
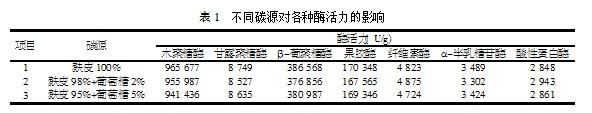
由表1可以看出,用麸皮及葡萄糖作为碳源及两者的混合物做复合碳源时,各种酶的活力相差很小,考虑到成本因素,选用麸皮作为单一碳源。
2.1.2 氮源对酶活力的影响
以最佳碳源麸皮为基础培养基,分别添加适量的豆粕、尿素、(NH4)2SO4、NH4Cl、NaNO3作为试验氮源,进行固态发酵试验,分别测定各项酶活力,结果如表2所示。
由表2可以看出,有机氮源豆粕及无机氮源(NH4)2SO4效果最好,NH4Cl、尿素为氮源时各项酶活力都较低,而以NaNO3为氮源时菌丝不生长,不结块。因此可以选择有机氮源豆粕及无机氮源(NH4)2SO4作为固体发酵培养基的复合氮源。
2.1.3 碳、氮源与疏松物的含量对酶活力的影响
为了使发酵料能疏松透气,以供给菌丝生长所需氧气及曲料散热,用稻壳与玉米芯粉作为掺和疏松物,同时玉米芯粉还可以作为诱导因子。试验对掺和疏松物以及碳源、氮源在培养基中的含量比例进行研究,找出最佳配比。
依据上面试验得到的碳、氮源,对培养基组成进行优化,采用L16(34)进行试验。其因素与水平取值如表3,以木聚糖酶活力为指示代表对试验结果进行相应的极差分析,发酵培养基整体优化正交试验结果及相应的级差分析见表4。
由表4可以看出,4个因素对酶活力的影响程度为D>B>A>C,即培养基中疏松物的量对酶活力影响程度最为显著,其次是碳源的量,再次是豆粕的添加比例,最后是(NH4)2SO4的添加量。由表4可以看出,4个因素的最佳组合为A2B2C2D2,由于这个条件不在这9次试验中,因此补加试验A2B2C2D2,得到木聚糖酶活力为1 087 638 U/g、甘露聚糖酶活力为10 673 U/g、β-葡聚糖酶活力为457 834 U/g、果胶酶活力为216 569 U/g、纤维素酶活力为5 089 U/g、α-半乳糖苷酶活力为3 853 U/g、酸性蛋白酶活力为3 128 U/g。均高于最高的8号试验,因此以A2B2C2D2为最佳组成。
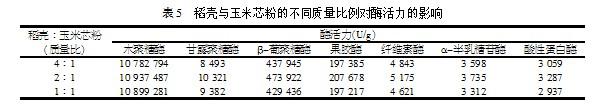
由上面试验可以看出,培养基中疏松物含量对酶活力的影响较大,由于疏松物由诱导因子玉米芯粉和稻壳组成,因此还要研究两者之间的添加比例,其结果如表5所示。由表5可以看出,当稻壳与玉米芯粉的质量比为2:1时,各项酶活力最高。
2.1.4 营养因子对酶活力的影响
以上面试验得到的最佳培养基为基础培养基,添加少量的营养因子A、B、C、D,固体发酵测定酶活,其结果如表6。
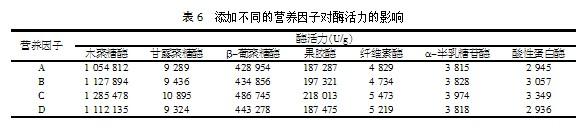
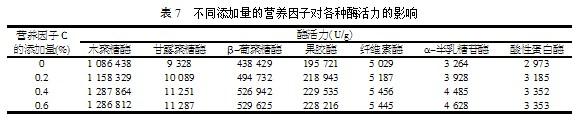
由表6可以看出,当添加一定量的营养因子C时,各项酶活力有明显的升高。酶活力升高的程度与营养因子的添加量有关,通过在100 g培养基中添加不同量的营养因子C,研究其添加量对各项酶活力的影响程度,结果如表7所示。
由表7可以看出,当每100 g培养基中加入0.4 g营养因子C时,各项酶活力曲线均处于最高值,因此选择营养因子C的最佳添加量为0.4%。
2.2 发酵培养条件的优化选择
2.2.1 接种量对产酶活力的影响
适当的接种量有利于菌丝体的生长、培养基营养物质的合理利用及酶的形成,较低的接种量形成的菌丝体粗壮,由于菌丝体密度不够,不利于高浓度产酶的形成;过高的接种量由于营养物质过度吸收,菌丝体细小,散热困难,不易排出废气,一般产酶能力也较低;只有当接种量合适时,形成适宜的生物量才能达到最大的产酶表现值。通过试验不同的接种量得到如表8的结果。
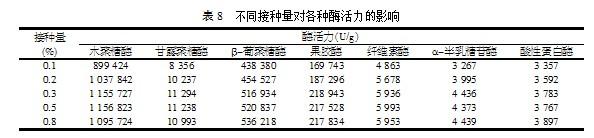
由表8可以看出,当接种量为0.3%时,各项酶活力基本上已达最高点。
2.2.2 培养温度对酶活力的影响
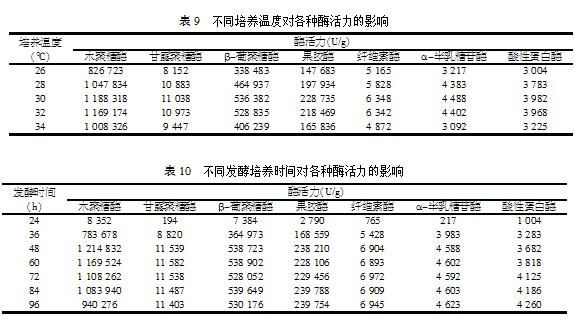
当发酵培养温度大于35 ℃时,曲霉生长代谢受到明显的抑制,产酶率下降,温度达到40 ℃几乎不能生长,因此发酵培养温度对产酶活力有很大的影响,研究不同发酵培养温度下的酶活力,结果如表9。
由表9可以看出,当发酵培养温度为30 ℃时,各项酶活力最高,因此选用30 ℃作为发酵培养温度。
2.2.3 发酵培养时间对酶活力的影响
复合酶生产发酵以产酶活力达最高点为发酵成熟标志。对发酵培养时间进行研究发现(见表10),木聚糖酶在前48 h内,酶活力急剧增加,48 h之后酶活力开始降低。甘露聚糖酶、纤维素酶、β-葡聚糖酶、α-半乳糖苷酶在前48 h内酶活力递增,48 h后酶活力基本无变化。酸性蛋白酶在前96 h酶活力一直处于上升趋势。果胶酶在48 h酶活力达到最大,之后酶活基本稳定不变。因此综合考虑,确定48 h作为固体发酵培养时间。

3 工业化生产
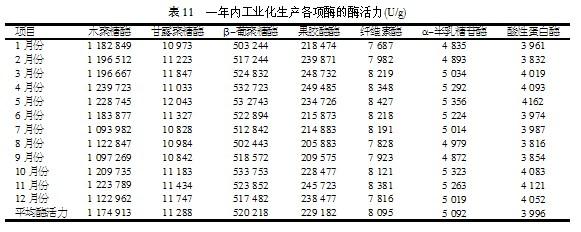
用以上试验得到的优化培养基配比及发酵培养条件进行了工业化生产,并将一年生产的各种酶活力数据进行了统计(见表11)。由表11可以看出,从1月份到12月份各种酶活力平均约为:木聚糖酶120万U/g、甘露聚糖酶11 000 U/g、β-葡聚糖酶52万U/g、果胶酶23万U/g、纤维素酶8 000 U/g、α-半乳糖苷酶5 000 U/g、酸性蛋白酶4 000 U/g。
4 结论
经过大量的试验及生产应用,得到该黑曲霉菌种固体发酵生产饲用复合酶的发酵条件,固体发酵培养基:麸皮64 g、豆粕粉5 g、(NH4)2SO4 1 g、稻壳20 g、玉米芯粉10 g、营养因子C 0.4 g。发酵条件:接种量0.3%,发酵培养温度30 ℃,发酵培养时间48 h。将上面得到的最优化培养基及发酵培养条件用于工业化生产,结果表明其酶活力高且生产稳定。
(编辑:沈桂宇,guiyush@126.com)
范志恒,山东康地恩集团,高级工程师,266061,山东青岛。
收稿日期:2009-06-08