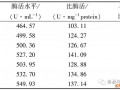
摘 要 通过平板快速筛选方法从土壤样品中分离得到一株产葡萄糖氧化酶菌株,此菌株属于产胞内酶的黑曲霉。采用文献报道的相关工艺测得其初始酶活为0.86 μmol/min。经过培养基配方的优化试验及摇床发酵工艺的调整,其摇床发酵的产酶率有了较大的提高,发酵液过滤液酶活达到9.91 μmol/min。
关键词 葡萄糖氧化酶;发酵;筛选
中图分类号 Q554
葡萄糖氧化酶(EC.1.1.3.4 β-D-葡萄糖氧化还原酶,简称GOD)能专一地催化β-D-葡萄糖与氧发生氧化反应,氧化后生成D-葡糖酸内脂,并释放出过氧化氢,自动地继续同水反应形成葡糖酸,其反应式如下:
目前,GOD的生产条件一般都采用黑曲霉和青霉菌株作为生产菌。自从20世纪50年代起葡萄糖氧化酶体系已经被安全有效地应用于食品和饮料工业上,通常是用来提高保藏期和保持风味稳定性。与其它化学抗氧化剂相比,葡萄糖氧化酶是一种天然产物。作为一种催化剂它能提供连续的保护,因为它不会在反应中被破坏。葡萄糖氧化酶在仪器工业上有广泛的用途,主要有去葡萄糖、脱氧、杀菌、测定葡萄糖含量等作用。葡萄糖氧化酶具有改善面团强度和弹性,提高面包质量的作用,它与其它酶制剂和VC之间具有协同效应,用于烘焙面包,能获得理想的烘焙效果,同时葡萄糖氧化酶凭其天然的优良特性,可作为一个较为理想的溴酸钾取代物。我国是一个面粉生产大国,因此葡萄糖氧化酶具有广阔的应用前景。
1 材料与方法
1.1 培养基
1.1.1 平板分离培养基
底层培养基:葡萄糖 80 g/l、蛋白胨 3 g/l、(NH4)2HPO4 0.388 g/l、KH2PO4 0.188 g/l、MgSO4·7H2O 0.156 g/l、CaCO3 3.5 g/l、琼脂 20 g/l,自然pH值。
上层培养基:葡萄糖 80 g/l、可溶性淀粉 10 g/l、KI 1.7 g/l、去氧胆酸钠 0.2 g/l、磷酸缓冲液0.1 mol/l、琼脂 20 g/l,pH值5.6。
1.1.2 种子培养基
NaNO3 2 g/l、K2HPO4 1 g/l、KCl 0.5 g/l、MgSO4 0.01 g/l、蔗糖 30 g/l、琼脂 20 g/l,自然pH值。
1.1.3 发酵培养基
葡萄糖 80 g/l、蛋白胨 3 g/l、KH2PO4 2 g/l、MgSO4·7H2O 0.7 g/l、KCl 0.5 g/l、NaNO3 4 g/l,自然pH值。
1.2 培养条件
斜面培养:30 ℃恒温培养3 d后置于5 ℃冰箱保存备用。
摇床培养:30 ℃恒温摇床培养6 d,摇床转数为200 r/min。
1.3 菌株筛选与诱变
1.3.1 初筛
根据Fiedure K. J. 显色法,称取10 g采集来的土样于灭菌处理的装有100 ml生理盐水且含有玻璃珠的250 ml锥形瓶中振荡30 min。然后用无菌水稀释成10-4、10-5两个稀释度,分别用灭菌的移液管吸取0.1 ml涂布于预先配制并且灭菌的分离培养基中,在28 ℃下培养3 d后置于5 ℃冰箱中静置2 d,然后在室温下存放至出现蓝色颜色圈。选取颜色圈中的菌株接种到斜面上培养。
1.3.2 复筛
将初筛得到的斜面转接于摇瓶中继续培养6 d,测定发酵液的酶活。
1.3.3 诱变
用0.85%的生理盐水洗下斜面上的孢子,使每毫升溶液含106个孢子,然后取0.5 ml的孢子悬浮液,加入现配的0.05 mol/l NaNO2溶液0.5 ml,充分摇匀后使终浓度为0.025 mol/l。在27 ℃保温10 min后加入9 ml浓度为0.07 mol/l、pH值为8.6的Na2HPO4溶液中止反应。稀释涂平板后置于30 ℃培养箱内培养,一定时间后选取可疑菌株接到斜面进行培养,再经摇床发酵培养后进行酶活测定。
1.4 酶活的测定方法
取250 ml三角瓶,加入2%葡萄糖磷酸缓冲液(pH值5.6)25 ml及1 ml酶液,立即于29 ℃下振荡l h,然后加入0.1 mol/l NaOH溶液20 ml以终止反应,用0.1 mol/l盐酸滴定剩余的NaOH,记录所消耗的盐酸毫升数A;对照样在加酶液之前加入0.1 mol/l NaOH溶液20 ml,不必振荡,其它操作相同,记录所消耗的盐酸毫升数B。
酶活单位表示方法:在上述试验条件下,每分钟催化氧化1 μmol葡萄糖所需的酶量定义为一个酶活单位(μmol/min)。
计算式为: GOD酶活=[(B-A)×f×N×1 000]/60。
式中:N —— 盐酸浓度(0.1 mol/l);
f —— 稀释倍数。
2 结果与分析
2.1 筛选结果
经过对在不同地点取得的40个土样进行初筛和复筛得到几株具有GOD活性的菌株,其酶活如表1所示。挑选酶活最高的一株命名为GD-GD,经过镜检观察其形态,发现它是一株霉菌,其孢子颜色为黑色,菌丝有隔,断定其为黑曲霉,测得其酶活为0.86 μmol/min。用冷冻法将筛选得到的菌株保藏起来,并以这个菌种进行后面的试验。

2.2 摇瓶工艺研究
2.2.1 培养基配方试验
2.2.1.1 碳源试验
在发酵培养基中使用浓度为8%的不同种类碳源,培养基中其它成分与含量均保持不变。在30 ℃下培养6 d。测定发酵过滤液的酶活,其结果见图1。
从图1可以看出,该菌对不同的碳源具有不同的选择性。使用葡萄糖为碳源时其发酵液的酶活达到0.86 μmol/min,由此判断葡萄糖是该菌的最佳碳源。
2.2.1.2 碳源浓度试验
在碳源试验结束后,选用葡萄糖作为其碳源,分别用4%、6%、8%、10%、12%、14%的碳源浓度进行摇床发酵培养,培养条件同碳源试验。测定其发酵过滤液的酶活,结果见图2。
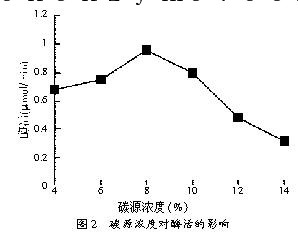
从图2可见,以葡萄糖作为碳源时的最佳浓度为8%时,发酵过滤液的酶活最高,为0.96 μmol/min。因此,最佳的碳源浓度为8%。
2.2.1.3 氮源试验
以8%的葡萄糖为碳源,改变摇床发酵培养基中的氮源种类,其浓度仍为0.7%。同样的培养条件下培养6 d。测定发酵液的酶活,结果见图3。
试验结果表明,当蛋白胨与NaNO3以3:4的比例混合能达到较好的产酶效果,其发酵液的酶活可达到1.03 μmol/min。
2.2.1.4 正交试验
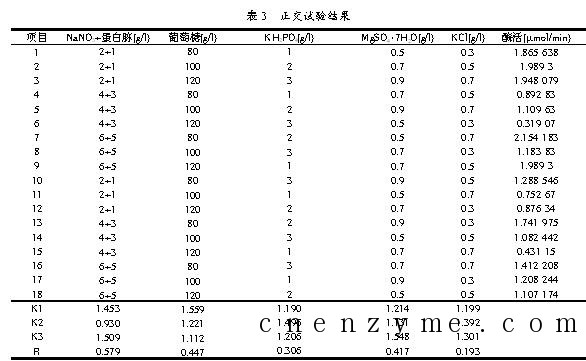
由前面的试验可见,把NaNO3与蛋白胨视为一个因子,发酵培养基中的其它组成成分分别作为一个因子。设计一个5因子3水平的正交试验。选用L18(35)正交表。试验中各因子与水平排列如表2所示,试验中各因子与水平的设计以及试验结果见表3。
根据正交试验的结果,该菌株产酶的最佳培养基配方组合见图4。


由正交试验结果可知,最佳发酵培养基组成为:葡萄糖80 g、蛋白胨5 g、NaNO3 6 g、KH2PO4 2 g、MgSO4·7H2O 0.9 g、KCl 0.5 g。
2.2.2 发酵液的后处理(见图5)
用上述的最佳培养基培养,培养条件不变,最后对发酵液编号分别做不同的后处理。由试验结果可以看出,经过超声波处理后酶活有大幅度的提高,而静置处理与5 ℃放置都对酶活影响不大。说明此菌产生的是胞内酶。经过超声波破壁后胞内酶释放出来后,酶活就提高了。在下一步骤测定酶活的试验之前先把发酵液用超声波处理30 min。
2.2.3 不同发酵条件对产酶的影响
2.2.3.1 产酶进程试验
用上述的培养基进行摇床培养6 d,分别测定发酵液的酶活,结果见图6。
由图6可见,最佳培养时间为4 d,酶活可达7.04 μmol/min。
2.2.3.2 培养基初始pH值对产酶的影响
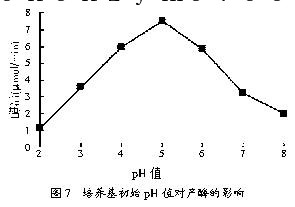
用HCl和NaOH调节灭菌前培养基的初始pH值,进行摇床发酵,分别测定发酵液的酶活,结果见图7。
从图7可以看出,培养基的初始pH值对该菌产酶是一个重要的影响因素,其产酶最适的初始pH值为5,酶活可以达到7.52 μmol/min。
2.2.3.3 装料量对产酶的影响
在250 ml的三角瓶中分别测定不同的装料量对产酶的影响,试验结果见图8。
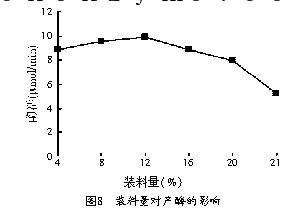
从图8中可以看出,对于250 ml的三角瓶,12%的装料量最有利于该菌产酶。
经过上述的优化过程后,该菌的产酶能力得到了大幅度的提高,从原来的0.86 μmol/min提高到现在的9.91 μmol/min。
3 菌种诱变
取一支试管斜面,按前述的方法进行亚硝酸钠诱变,筛选后接种于摇瓶进行培养,测定发酵液的酶活。诱变后几个可疑菌株的发酵液酶活见表4。
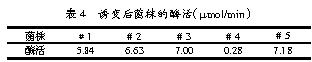
此次的诱变没有得到较好的结果,可能是因为筛选取的数量比较小。若加大筛选的量可能会取得较好的结果。
(编辑:高 雁,snowyan78@tom.com)
郭晓贤,福建师范大学生命科学学院,350108,福建师范大学闽侯新校区生活区A8-215。
刘峰,单位及通讯地址同第一作者。
收稿日期:2007-01-15