随着合成生物学和系统生物学的发展,全细胞生物催化和微生物发酵已可用来生产多种化工产品,不仅可生产小分子代谢产物,还可生产大而复杂的代谢产物,如多酚、类胡萝卜素、萜类、植物脂氧合酶等。但是,这些分子的产量往往很低,由于微生物宿主所需酶的低表达等因素。加氧酶(如细胞色素 P450单加氧酶和Baeyer-Villiger 单加氧酶(BVMOS))是制备复杂代谢产物的关键酶,然而它在微生物宿主细胞中通常很难表达。目前,优化在微生物宿主细胞中异源蛋白的功能性表达的方法有:优化基因表达的诱导条件(如培养温度、诱导剂的种类和浓度),启动子、核糖体结合位点(RBSs)、5′-非翻译区(5′-UTR)等基因表达系统优化,定向进化等蛋白质工程方法。
BmoF1,是一种来自荧光假单胞菌(P. fluorescens DSM50106)的Baeyer-Villiger单加氧酶,已有研究报道,它可催化氧插入酮基相邻的碳骨架。然而,它非常难以在大肠杆菌中表达。基因表达系统的优化、 BmoF1的定向进化都无法改善。而基因改造5′-UTR 可提高可溶性蛋白的表达水平。根据最近的一项研究,由310个核苷酸组成的3′-UTR可显著影响沙门氏菌(Salmonella enterica hilD)的mRNA稳定性。例如,3′-UTR的缺失会导致hilD mRNA水平增加,从而使该基因表达增强。基于这项研究,本研究人员假设BmoF1 mRNA的稳定性可通过3′-UTR来调节,从而可能会影响细胞内新合成的BmoF1多肽浓度。实验结果表明,根据假定的RNase E内切酶裂解位点在3′UTR的数目,以可溶性形式的bmof1和mo16(图1、2)表达水平以及在体内的催化活性明显改善。
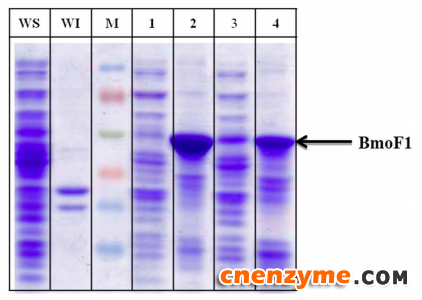 图1
图1
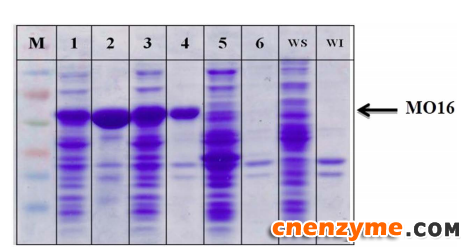 图2
图2