刘丽莉*,杨陈柳,李玉,梁严予,李丹,孟圆圆,代晓凝
(河南科技大学 食品与生物工程学院,河南 洛阳,471023)
摘 要 胶原蛋白酶是特异性水解天然胶原蛋白或明胶的酶类。为制备新型的骨胶原蛋白酶并探讨其降解胶原蛋白的能力,通过采用硫酸铵分级沉淀、DEAE-Sepharose Fast Flow离子交换层析、Sephadex G-100凝胶层析等分离纯化步骤,从BacilluscereusMBL13-U菌株的粗酶液中分离纯化出一种特异性降解牛骨胶原蛋白的胶原蛋白酶(bone-specific collagenase,BSC),对该酶的分子质量、底物特异性和降解能力进行了分析,并构建出其降解牛骨胶原蛋白的动力学模型。结果表明:分离纯化的BSC比活力为5.57×103U/mg,纯化倍数达到42.85倍,分子质量约为52.0 kDa。经特异性分析该酶为骨胶原蛋白酶,且有显著的水解I型胶原蛋白的能力。其水解能力优于其他常用的蛋白酶。构建出该酶降解牛骨胶原蛋白的动力学模型为:降解速率R=(583.813 6E0+1.296 7S0)exp(-0.119 0DH),水解度
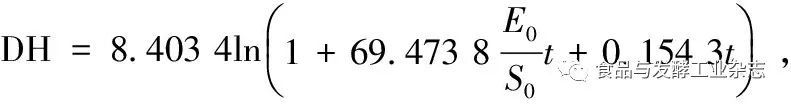
酶的失活常数K4为64.115 7 /h。
关键词胶原蛋白;纯化;骨胶原蛋白酶;动力学;降解
我国的养殖业发展迅速,如何有效利用畜禽屠宰后的副产物,成为近年来的研究热点。利用酶技术对我国来源广泛的畜禽骨资源进行深加工,既解决了大量畜禽骨骼的浪费问题,又带来了一定的经济效益[1-2]。胶原蛋白酶是通过胶原的解螺旋作用降解胶原蛋白却不作用于其他蛋白底物的酶类。胶原蛋白肽是胶原蛋白经降解后所得的小肽混合物,其具有相对分子质量小、易吸收、抗氧化、降血压、增强免疫力等诸多生理活性[3-4]。从来源上,胶原蛋白酶可分为微生物胶原蛋白酶和动物胶原蛋白酶,而微生物源的胶原蛋白酶因其高酶活等优点被广泛采用,如FERREIRA等[5]通过曲霉菌生产胶原酶,并对所产酶分离纯化及酶学特性研究。NAGANO等[6]从枯草芽孢杆菌培养基的上清液中分离胶原酶,研究酶纯化后的特异性。ABFALTER等[7]从蜡状芽孢杆菌ATCC 14579中克隆出胶原酶ColA基因并对其表达机制进行研究。在工业开发中胶原蛋白酶可应用于胶原蛋白分级降解获得胶原多肽,而由于骨骼中主要的蛋白质为胶原蛋白,因此选用专用的胶原蛋白酶进行酶解则具有很高的研究价值。
蛋白的降解过程是集复杂和多样于一体的过程[8-10],不同的蛋白酶和降解条件都会对蛋白质的降解产生很大的影响,很难在生产应用上掌握和调控蛋白的降解过程。因此,从反应机理出发,推导描述蛋白质降解过程规律的动力学关系,得出动力学参数,建立符合实验数据的实验模型,对于蛋白质降解过程的深入理解有重要意义[11-12]。本研究以课题组筛选的菌种BacilluscereusMBL13-U为出发菌种,将其粗酶液依次采用多种分离纯化步骤,纯化出一种特异降解牛骨胶原蛋白的酶,并对其特性进行了相关分析。同时,参照相关研究[13-15],以米氏方程为基础,针对骨胶原蛋白酶(bone-specifi collagenase,BSC)降解牛骨胶原蛋白的动力学进行探讨,从而构建出降解牛骨胶原蛋白的动力学模型。该项研究为新型胶原蛋白酶源的开发及其未来开发应用奠定了科学理论意义。
1. 1 材料与试剂
新鲜牛腿骨,洛阳老城区农贸市场; 牛跟腱Ⅰ、Ⅱ、Ⅲ型胶原蛋白,DEAE琼脂糖凝胶FF,上海源叶生物有限公司;牛血清白蛋白,众一生物公司;葡聚糖凝胶G100,上海蓝季科技;甲醛、HCl、NaOH,洛阳昊化化学试剂有限公司;其他试剂均为分析纯。
1. 2 仪器与设备
THZ-130B恒温培养摇床,上海一恒科学仪器有限公司;高速冷冻离心机,湖南湘仪仪器有限公司;紫外分光光度计,上海精密仪器有限公司;BS-100A自动部分收集器、BT-100数显恒流泵、TH-500梯度混合仪,上海青浦沪西仪器厂;电泳仪,北京六一仪器厂。
1. 3 实验方法
1.3.1 牛骨胶原蛋白的制备
新鲜牛骨→除杂→切块(5~6 cm)→高压蒸煮(121 ℃,0.1 kPa)→脱脂、脱钙(0.48% HCl) →水洗→烘干→粉碎(40目筛)→牛骨胶原蛋白[16]
1.3.2 BSC粗酶液的制备
参照课题组前期实验确定的最佳产酶条件进行培养菌种[17],将B.cereusMBL13-U以4 mL/100mL的接种量接种于pH 6.4的发酵培养基中,在35 ℃,160 r/min的条件下反应46 h,以14 800g离心力,4 ℃高速离心25 min,收集上清液即为BSC的粗酶液M1样。
1.3.3 BSC的分离纯化
向M1样中缓慢加入(NH4)2SO4,使其溶液饱和度达到30%,4 ℃静置8 h后,在离心力为14 800g,4 ℃条件下高速离心25 min,接着向上清液中加入(NH4)2SO4,使其溶液饱和度达到75%,采取同样方法离心,收集沉淀;沉淀用去离子水溶解离心,将上清液移入透析袋内,4 ℃,2~3 h更换一次去离子水,将透析后的去离子水用BaCl2检测,直到检测不出沉淀,透析结束。透析后冷冻干燥得到M2样。然后将M2样溶液用DEAE-Sepharose Fast Flow离子层析柱进行洗脱,洗脱速度为0.8 mL/min,按4 mL/管,定时5 min的速度收集洗脱液,得到M3样[18]。取M3样溶液1 mL加入Sephadex G-100凝胶层析柱进行洗脱,洗脱速度为0.5 mL/min,按2.5 mL/管,5 min的速度收集洗脱液,收集酶活较高的部分,干燥后得到BSC的纯品。
1.3.4 BSC分子质量及纯度鉴定
BSC的分子量及纯度鉴定采用SDS-PAGE垂直电泳法[19]进行分析,本试验选择的分离胶为10%,浓缩胶为5%。
1.3.5 不同蛋白酶对牛跟腱I型胶原蛋白的作用对比
分别将BSC、木瓜蛋白酶、风味蛋白酶、胃蛋白酶、中性蛋白酶作用于牛跟腱I型胶原蛋白上,在温度为50 ℃和pH 6.5条件下反应6 h后,沸水浴5 min,冷却后离心取上清液,对其进行水解度测定。
1.3.6 BSC的底物特异性
将BSC分别作用于牛血清白蛋白,牛跟腱I型胶原蛋白、牛跟腱II型胶原蛋白、牛跟腱Ⅲ型胶原蛋白,在温度为50 ℃和pH 6.5条件下反应6 h后,沸水浴5 min,冷却后离心取上清液,分别测其水解度。
1.3.7 BSC降解牛骨胶原蛋白过程中蛋白降解动力学分析
1.3.7.1 BSC降解牛骨胶原蛋白过程监测
将分离纯化出的BSC作用于牛骨胶原蛋白,研究降解过程中酶添加量(0.12、0.22、0.32、0.42 g/100 mL)和牛骨胶原蛋白添加量(4.14、5.14、6.14、7.14 g/100 mL)对水解度的影响。其中,调节反应液至pH 6.5,将其置于恒温培养摇床中在46 ℃的条件下反应8 h,分别在每隔30 min对应的反应时间下将反应液沸水浴灭酶15 min,以6 570g的离心力离心15 min,得上清液测其水解度。
1.3.7.2 BSC降解牛骨胶原蛋白过程中蛋白降解动力学模型的构建
通过BSC降解牛骨胶原蛋白中不同BSC添加量和牛骨粉添加量对其水解度的影响,根据各研究学者前期的模型构建,结合本试验的相关参数,推导出符合本研究BSC降解牛骨胶原蛋白过程中蛋白降解动力学的模型,并对该模型进行验证试验,以确保模型的有效性。
1. 4 测定方法
(1)BSC酶活的测定:茚三酮显色法[20]。
(2)BSC的蛋白质含量的测定:Bradford法[20]。
图1为利用Origin 8.5得到的牛血清白蛋白标准曲线。牛血清白蛋白标准曲线的回归方程为y=0.021 85x+0.065 75,R2=0.994 13。
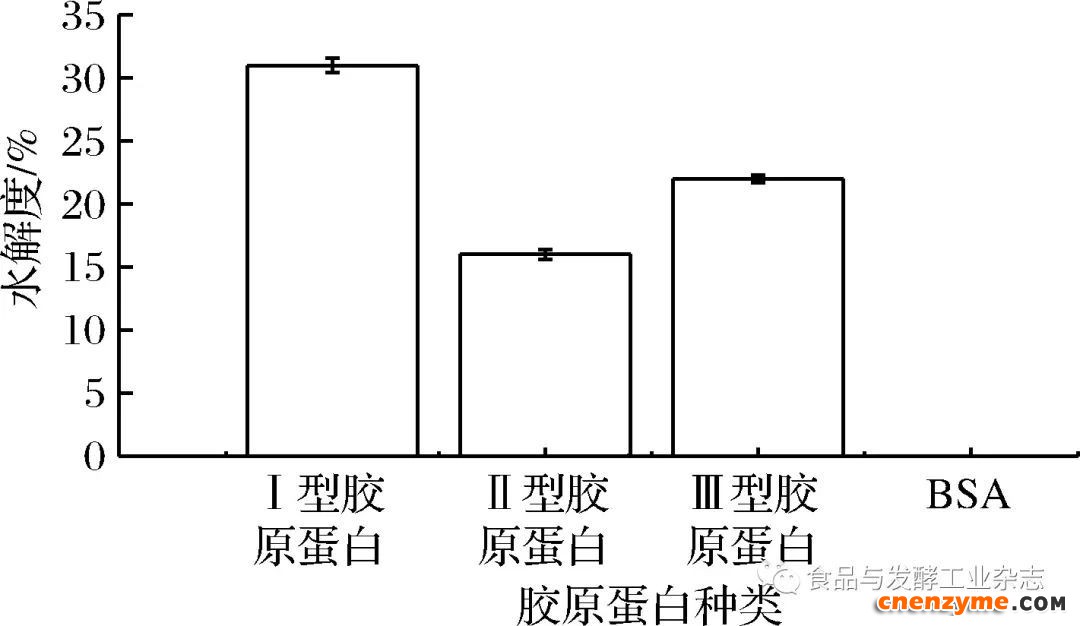
图1 牛血清白蛋白标准曲线
Fig.1 The standard curve of bovine serum albumin
(3)水解度的测定:甲醛-电位滴定法[21]。
1. 5 数据处理
采用Origin 8.5对试验数据进行统计分析。
2 结果与分析 2. 1 BSC分离纯化结果
将(NH4)SO4沉淀后的M2样进行DEAE-Sepharose Fast Flow离子交换层析的分离纯化,结果如图2。
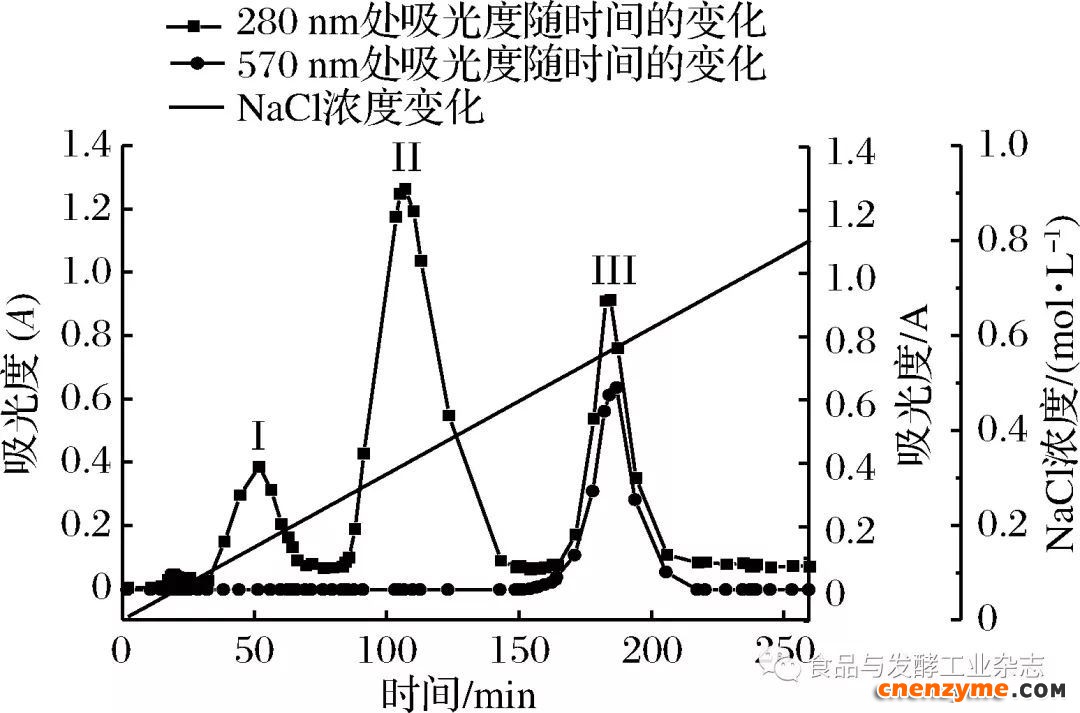
图2 BSC的DEAE-Sepharose Fast Flow离子交换层析图
Fig.2 The DEAE-Sepharose fast flow ion exchange chromatography of BSC
图2中结果表明,整个M2样的洗脱时间为260 min,期间共出现了30~75 min的洗脱峰I、85~150 min的洗脱峰II、170~235 min的洗脱峰Ⅲ3个明显分离的洗脱峰,分别对这3个明显的洗脱峰进行胶原蛋白酶酶活的检测,发现仅在洗脱峰Ⅲ的时间范围内检测出了胶原蛋白酶酶活,证明在170~235 min洗脱时间内分离出的为BSC,为了保证BSC的纯度,收集180~185 min内的洗脱液,此时NaCl的浓度为0.57 mol/L左右,此范围内收集的BSC活达到最高,重复多次试验,收集BSC洗脱液,于真空冷冻干燥箱内干燥得M3样。将M3样进行Sephadex G-100凝胶层析,如图3所示。
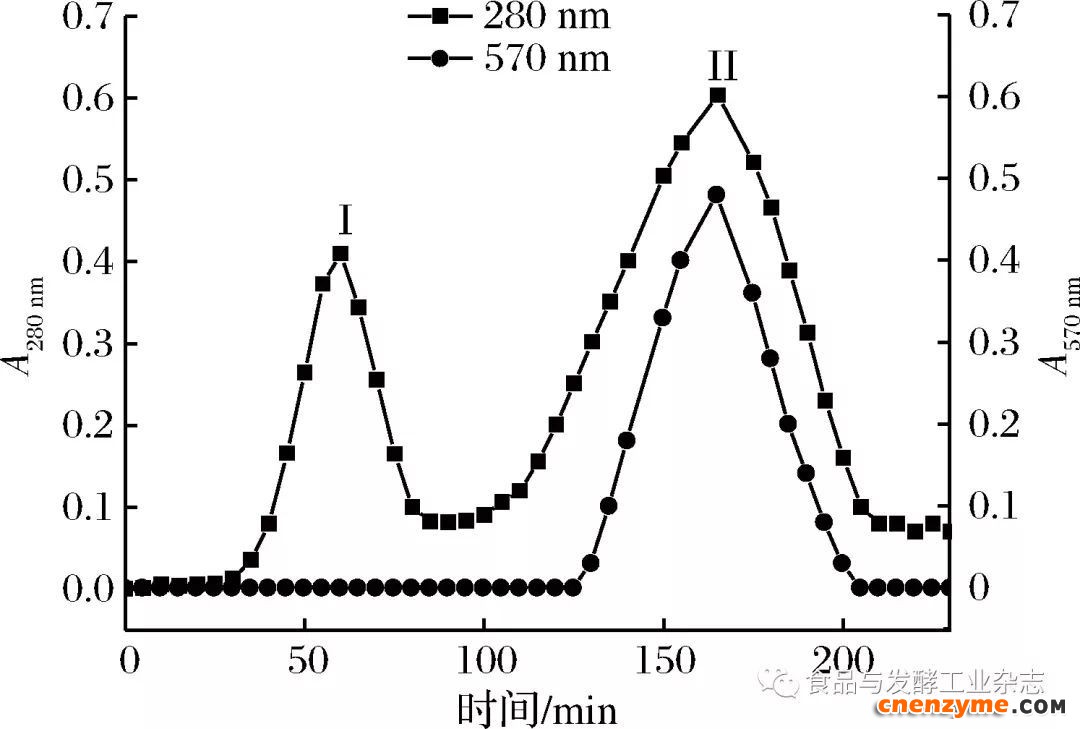
图3 BSC的Sephadex G-100凝胶层析图
Fig.3 The sephadex G-100 gel chromatogram of BSC
由图3可知,M3样的洗脱时间为230 min,在整个分离纯化期间共出现了2个完全分离的洗脱峰,洗脱峰I、II出现的时间为40~80 min和120~200 min,分别对洗脱峰I和II中的各管BSC的洗脱液进行酶活检测,结果发现仅在洗脱峰II的时间范围内检测出了胶原蛋白酶酶活,证明在120~200 min的洗脱时间内分离纯化出的为BSC,为了保证BSC的纯度,我们选取155~165 min内的洗脱液进行收集,此范围内收集的BSC酶活达到最高,重复多次试验,收集BSC洗脱液,真空冷冻干燥后的BSC纯品。
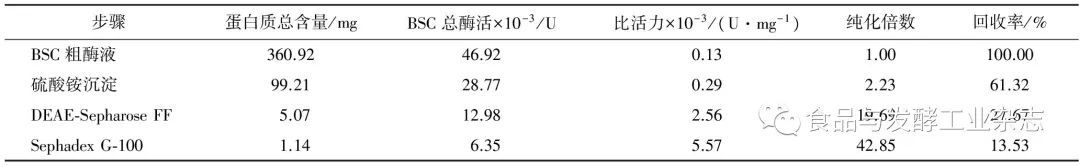
由表1可知,在BSC粗酶液中总酶活为46.92×103U,蛋白质总含量为360.92 mg,经过(NH4)2SO4沉淀后BSC中大部分杂质已经除去,再经过2次柱层析的分离纯化后BSC的蛋白质总含量为1.14 mg,总酶活为6.35×103U,比活力为5.57×103U/mg,纯化倍数达到42.85倍,纯化效果良好。
表1BSC的分离纯化结果
Table1TheisolationandpurificationresultsofBSC
2. 2 BSC分子量及纯度鉴定
分别对各步处理的BSC样品进行SDS-PAGE纯度鉴定,并对最后分离纯化出的纯酶进行分子质量的测定,结果如图4所示。
图4表明,M2样条带较多,证明此时的酶液中含有较多的杂蛋白质;M3样仅有几条明显的条带,表明M3样大部分的杂蛋白被分离除去;当M3样经Sephadex G-100凝胶层析纯化过后,只有1条明显的条带,证明此时分离纯化出的BSC已达到了电泳纯的程度,为BSC纯酶。目前有关胶原蛋白酶的研究,如李星硕等[22]纯化的胶原酶的分子质量为100.0 kDa,龚福明等[25]从枯草芽孢杆菌中提取的胶原蛋白酶分子质量为33.0 kDa,刘丽莉等[2]从蜡样芽孢杆菌中的得到的蛋白酶分子质量约为38.0 kDa,而本实验分离纯化的BSC的分子质量约为52.0 kDa,可以认定其为一种新型的蛋白酶。
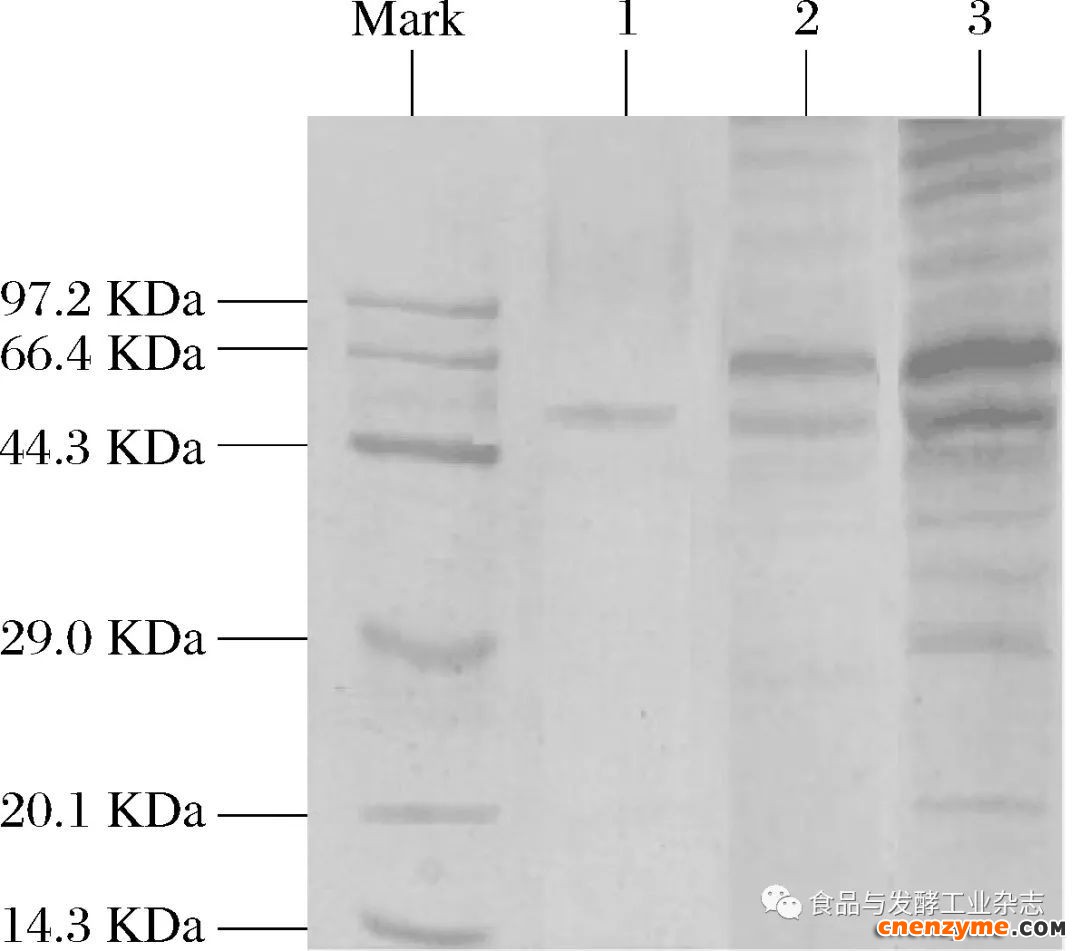
Mark—标准蛋白;1—Sephadex G-100凝胶层析后纯化的BSC; 2—DEAE -Sepharose Fast Flow阴离子层析后分离的BSC; 3—(NH4)2SO4沉淀后的粗酶液
图4 BSC的SDS-PAGE图谱
Fig.4 SDS-PAGE of purified BSC
2. 3 不同蛋白酶对牛跟腱I型胶原蛋白的作用对比
测定牛跟腱I型胶原蛋白在不同蛋白酶的作用下水解度的变化,结果见图5。
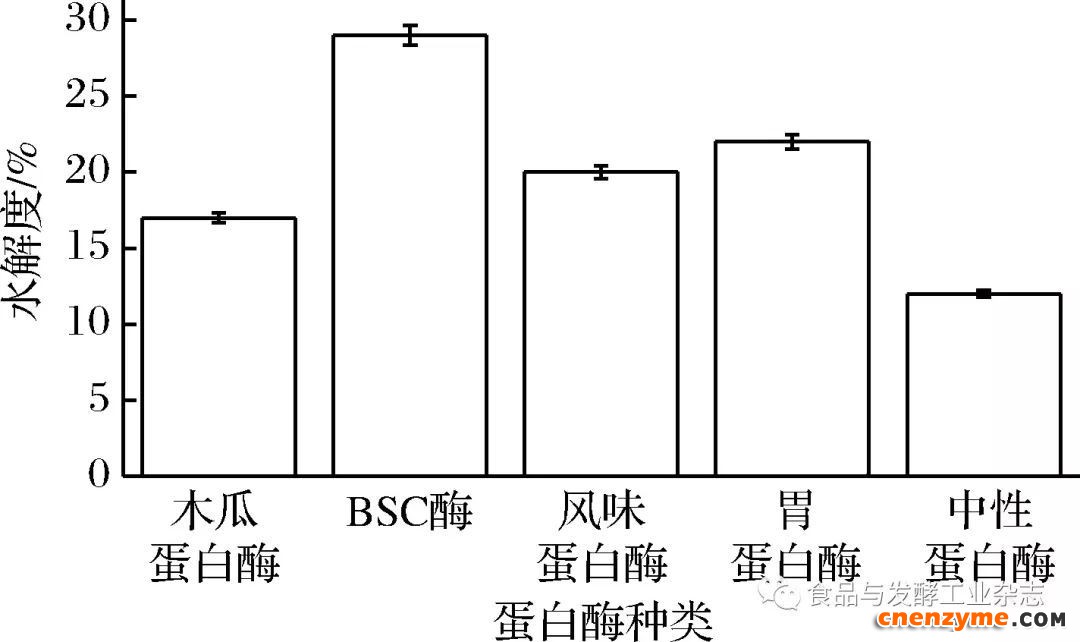
图5 不同蛋白酶对牛跟腱I型胶原蛋白的作用
Fig.5 The influences of different protease on type I collagen of bovine achilles tendon
由图5可知,5种酶降解能力为:BSC﹥胃蛋白酶﹥风味蛋白酶﹥木瓜蛋白酶﹥中性蛋白酶(p<0.05),结果表明BSC对降解牛跟腱I型胶原蛋白的作用显著,因此具有潜在的工业应用价值。
2. 4 不同蛋白底物在BSC作用下水解度的变化
将分离纯化的BSC酶作用于不同蛋白底物,结果如图6所示。

图6 不同蛋白底物对水解度的影响
Fig.6 The influences of different protein substrates on the degree of hydrolysis
图6表明,BSC酶对牛血清白蛋白没有降解作用,而对其他3种类型的胶原蛋白都表现出了降解能力,特别是对I型胶原蛋白的水解度高达31%,显著高于II、III型胶原蛋白的水解度为16%和22%(p<0.05),因此确定BSC酶具有特异降解I型胶原蛋白的能力。
2. 5 BSC降解牛骨胶原蛋白的动力学分析
2.5.1 不同BSC添加量和牛骨胶原蛋白添加量对降解过程中水解度的影响
针对不同的酶添加量和底物浓度,测定牛骨胶原蛋白的水解度变化,结果见图7。
由图7可知,随着BSC和骨胶原蛋白添加量的不断上升,水解度也逐渐提高。同时也可看出,在反应初期,两者的降解反应速率随着时间的延长均呈现出先迅速增加后变缓,最终基本保持不变。这是因为反应初期随着时间的不断延长,BSC与骨胶原蛋白充分结合反应,加快了反应速率,但是当到达一定的反应时间后,BSC与骨胶原蛋白反应基本完成,反应体系达到饱和,导致反应后期反应速率基本保持不变。
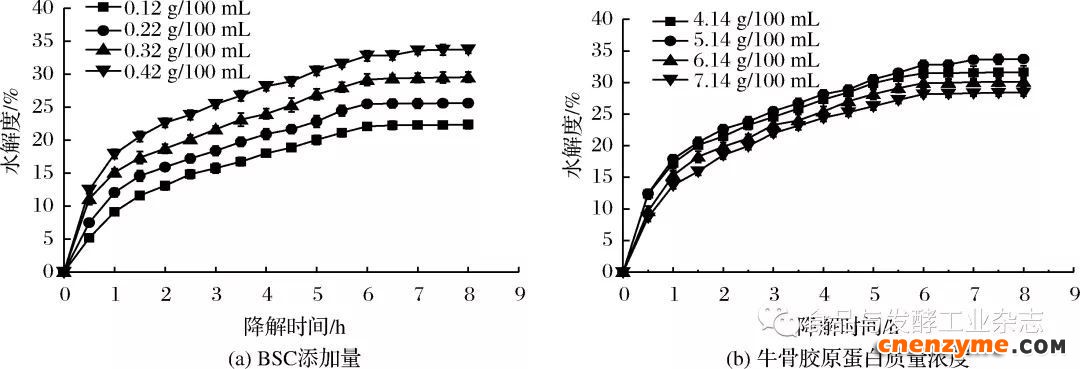
图7 酶添加量和底物浓度对降解过程中水解度的影响
Fig.7 The influence of adding amount of enzyme addition and substrate concentration on DH during degradation process
2.5.2 BSC降解牛骨胶原蛋白动力学的构建
BSC降解牛骨胶原蛋白的过程可以用Michaelis-Menten的快速平衡学说来反映[26],他们所建立的米氏方程可以有效地描述降解反应过程的动力学,即反应用的酶(E)与作用的底物(S)作用所产生的中间产物(ES)会再生成产物(P),反应过程如式(1)所示:
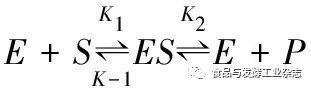
(1)
结合前期的许多研究学者[10,13]的数学推导,BSC降解骨胶原蛋白过程的动力学模型为:
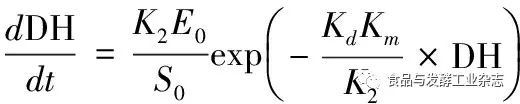
(2)
其中:DH为水解度,%;t为降解时间,h;E0为BSC添加量,g/100 mL;S0为牛骨胶原蛋白添加量,g/100 mL;K2为降解反应速率常数项,h-1;Kd为BSC失活反应速率常数项,h-1;Km为米式常数。
令
α=
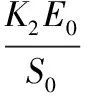
(3)
β=
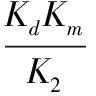
(4)
结合(2)、(3)、(4)得出BSC降解牛骨胶原蛋白过程中蛋白降解动力学模型为:
DH=ln(1+αβt)
(5)
R=αS0exp(-β×DH)
(6)
其中:R为降解速率。
2.5.3 BSC降解牛骨胶原蛋白的动力学各参数的确定
将图7中不同的BSC和牛骨胶原蛋白添加量和不同降解时间内水解度的变化分别带入式(5),利用Origin 8.5分别对其进行非线性拟合,拟合结果如表2所示。
表2降解过程拟合结果表
Table2Thefittingresultsofthedegradationprocess

由表2中的数据可以得出式(5)中对应的各个参数,如表3所示。
表3降解过程动力学参数表
Table3Thekineticparametersofthedegradationprocess
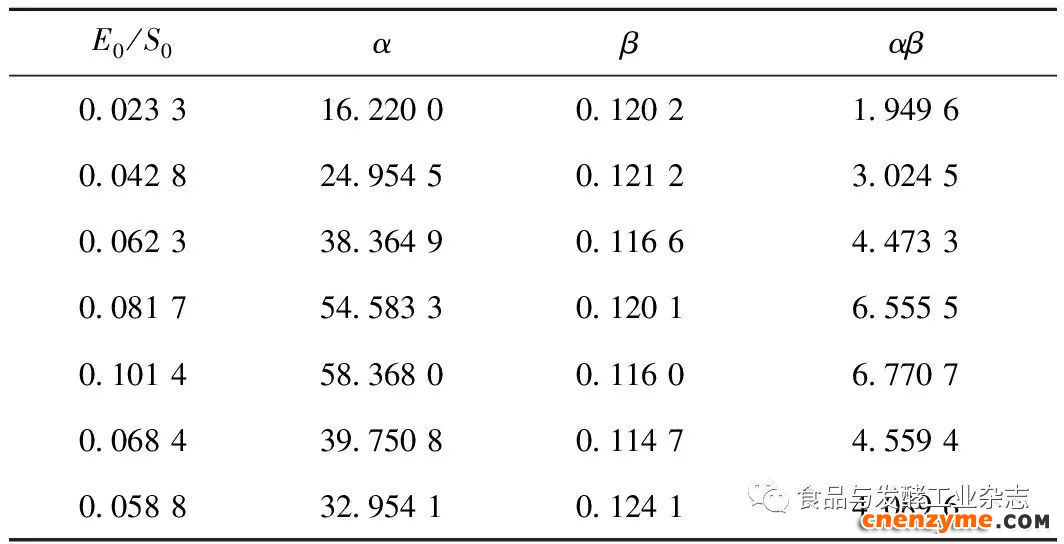
由表3可以得出,在恒温条件下,随着BSC添加量的逐渐增加,α呈现逐步增加的趋势,随着骨胶原蛋白添加量的逐渐增加,α反而逐步降低,这恰好与公式(3)相对应,α与BSC添加量成正比,与骨胶原蛋白添加量成反比,同时,在表3中可以看出,β并不随BSC添加量和牛骨胶原蛋白添加量的变化而变化,基本在0.119 0左右的范围内,由公式(4)中可以看出,在设定相同温度反应体系的前提下,β可当作常数。
由式(3)可知,α与BSC添加量和牛骨胶原蛋白添加量的比值呈线性关系,采用Origin 8.5对表3中E0/S0,α的结果进行线性拟合,得出结果为:
α=583.813 6+1.296 7
(7)
其中:R2为0.956 8。
将式(7)与式(3)结合,可得K2为583.816 3 h-1。
将α,β带入式(6),得出所构建的BSC降解牛骨胶原蛋白过程中蛋白降解动力学模型为:
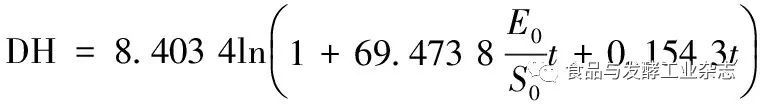
(8)
R=(583.813 6E0+1.296 7S0)exp(-0.119 0DH)
(9)
由张辉[10]的结果可知,
K4=KdKm
(10)
其中:K4为BSC降解牛骨胶原蛋白过程中BSC失活常数(h-1)。
将式(7)带入式(3)和式(4)得:
αβ=
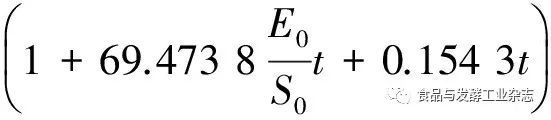
(11)
由式(11)可知,α、β的乘积与BSC添加量和牛骨胶原蛋白添加量的比值呈线性关系,采用Origin 8.5对表3中E0/S0,αβ的结果进行线性拟合,得出结果为:
αβ=67.115 7+0.282 7
(12)
其中:R2为0.942 7。
由式(12)可以得出,BSC降解牛骨胶原蛋白过程中BSC的失活常数K4为64.115 7 h-1。
2.5.4 BSC降解牛骨胶原蛋白的动力学模型验证
为了验证本模型,在反应温度46 ℃、牛骨胶原蛋白添加量5.14 g/100 mL、酶添加量0.42 g/100 mL、pH 6.5的条件下分别测得不同反应时间的水解度变化。如图8所示,与模型拟合值基本吻合,相对误差为0.45%,表明此模型能较好地描述牛骨胶原蛋白的降解过程,具有实际的应用价值。
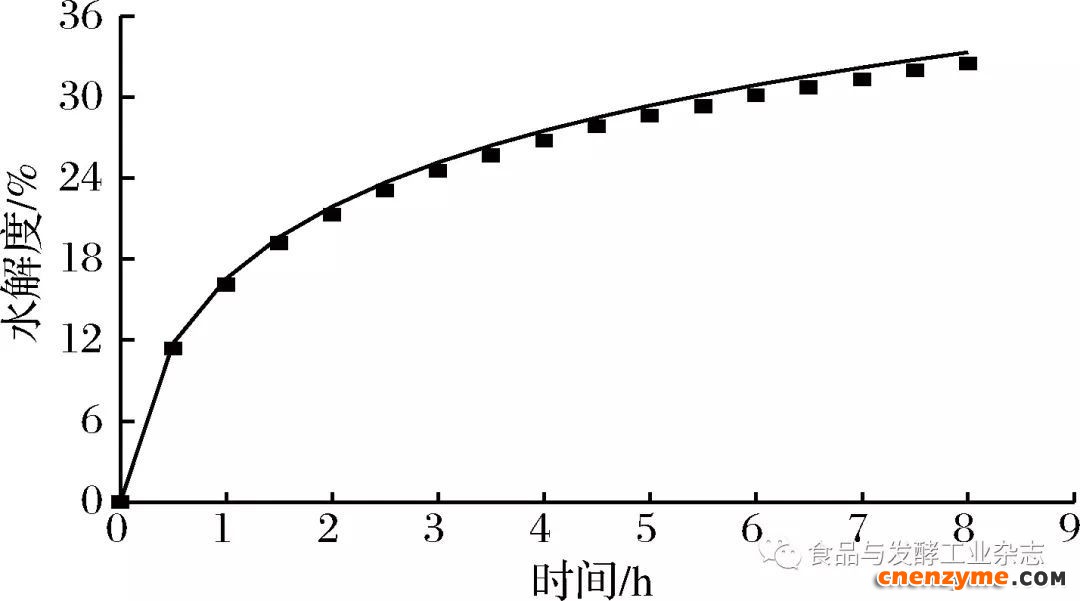
图8 水解动力学模型验证
Fig.8 Validation of hydrolysis kinetic model
3 结论
本研究从课题组筛选到的菌株BacilluscereusMBL13-U的粗酶液中,通过(NH4)2SO4分级沉淀、DEAE-Sepharose Fast Flow离子交换层析、Sephadex G-100凝胶层析,得到分子质量为52.0 kDa的BSC酶,其比活力为5.57×103U/mg,纯化倍数达到42.85倍,得率为 13.53%。经底物特异性分析该酶为骨胶原蛋白酶,对I型胶原蛋白具有显著的水解能力。通过对比试验表明其降解I型胶原蛋白的能力显著优于常用的蛋白酶。通过对不同的BSC添加量和牛骨胶原蛋白添加量对骨胶原蛋白降解过程中水解度影响,建立BSC降解牛骨胶原蛋白的动力学模型。同时得出BSC降解牛骨胶原蛋白过程中BSC的失活常数K4为64.1157/h。通过验证试验确定所建模型与实验值基本吻合,误差较小,具有较高的利用价值,为今后大规模生产提供良好的理论支持。
参考文献
[1] 王帅楠,宗红,陆信曜,等.利用酶解-发酵联用技术提高猪骨泥的功能性[J].食品与发酵工业,2015,41(4):87-90.
[2] 刘丽莉,马美湖,余秀芳,等.胶原蛋白酶产生菌的筛选及酶的分离纯化[J].生物工程学报,2010,26(2):194-200.
[3] KE L I,ER-HONG B O,YANG X H,et al.Study on anti-oxidant enzymatic hydrolysis of bone protein[J].Journal of Food Science & Biotechnology,2009,28(6):773-776.
[4] NIU R,JIAN-SHENG Y U.Antioxidant activity and purification of pollock peptides[J].Journal of Food Science & Biotechnology,2010(4):019.
[5] FERREIRA C M O,CORREIA P C,LIU T P S,et al.Collagenase produced fromAspergillussp.(UCP 1276) using chicken feather industrial residue[J].Biomedical Chromatography Bmc,2016,31(5):e3882.
[6] NAGANO H,TO K A.Purification of collagenase and specificity of its related enzyme fromBacillussubtilisFS-2[J].Bioscience Biotechnology & Biochemistry,2014,64(1):181-183.
[7] ABFALTERr C M,SCHÖNAUER E,PonNURAJ K,et al.Cloning,purification and characterization of the collagenaseColA expressed byBacilluscereusATCC 14579[J].Plos One,2016,11(9):e0162433.
[8] CUCU T,PLATTEAU C,TAVERNIERS I,et al.Effect of partial hydrolysis on the hazelnut and soybean protein detectability by ELISA[J].Food Control,2013,30(2):497-503.
[9] YUAN B,REN J,ZHAO M,et al.Effects of limited enzymatic hydrolysis with pepsin and high-pressure homogenization on the functional properties of soybean protein isolate[J].LWT - Food Science and Technology,2012,46(2):453-459.
[10] 张辉,齐宝坤,李杨,等.酶法制取大豆油脂过程中的蛋白酶解动力学[J].食品科学,2016,37(1):145-149.
[11] WANG Z,LOMBARDI J,SHAFFER J,et al.Kinetics of hydrolyzing isolated soy protein by an endopeptidase and its conceptual application in process engineering[J].International Journal of Food Studies,2012,1(1):26-32.
[12] SUNPHORKA S,CHAVASIRI W,OSHIMA Y,et al.Kinetic studies on rice bran protein hydrolysis in subcritical water[J].Journal of Supercritical Fluids,2012,65(5):54-60.
[13] LI S,YANG X,ZHANG Y,et al.Enzymolysis kinetics and structural characteristics of rice protein with energy-gathered ultrasound and ultrasound assisted alkali pretreatments[J].Ultrasonics Sonochemistry,2016,31:85-92.
[14] YU Z L,ZENG W C,ZHANG W H,et al.Effect of ultrasonic pretreatment on kinetics of gelatin hydrolysis by collagenase and its mechanism[J].Ultrasonics Sonochemistry,2016,29:495-501.
[15] 周向军,柳艳云,康涛涛,等.响应面法优化α-淀粉酶酶解高粱淀粉工艺及动力学研究[J].中国粮油学报,2016,31(5):135-140.
[16] 刘丽莉,李丹,尹光俊,等.牛骨血管紧张素转化酶抑制肽发酵动力学及结构与特性分析[J].食品科学,2017,36(2):52-58.
[17] 刘丽莉.牛骨降解菌的筛选及其发酵制备胶原多肽螯合钙的研究[D].武汉:华中农业大学,2010.
[18] 杨文华,李海星,刘晓华,等.黄曲霉毒素B1降解酶的分离纯化及其酶学特性[J].食品科学,2014,35(19):164-168.
[19] 李晔,张西轩,曹广秀,等.产胶原酶的蜡样芽胞杆菌发酵条件优化及酶的分离纯化[J].微生物学通报,2016,43(7):1 419-1 428.
[20] 李陈.一种新的短小芽孢杆菌胶原蛋白酶的分离、纯化及酶学性质研究[D].成都:四川农业大学,2008.
[21] 王冬燕,王远红,郭丽萍,等.纳豆中氨基酸态氮含量的测定[J].食品工业科技,2010(9):361-362.
[22] 李星硕,朱玥明,管于平,等.产胶原酶菌株的筛选鉴定、发酵优化及胶原酶纯化[J].微生物学报,2016,56(6):1 034-1 043.
[23] 徐超.蓝圆鲹肌肉金属蛋白酶的分离纯化及对胶原蛋白的作用[D].厦门:集美大学,2015.
[24] 王诚,张超群,吴海龙,等.鲤鱼肌肉中胶原蛋白酶的分离纯化与性质分析[J].集美大学学报(自然版),2013,18(4):261-266.
[25] 龚福明,柳陈坚,李海燕,等.枯草芽孢杆菌MN菌株由来胶原蛋白酶的纯化与生化性质[J].上海交通大学学报(农业科学版),2009,28(6):572-577.
[26] 钟昔阳,杨积东,汤玉清,等.α-淀粉酶酶解小麦面粉动力学模型研究[J].食品科学,2012,33(7):96-100.
Purification of BacilluscereusMBL13- U collagenase anddegradation kinetics of collagen
LIU Li-li1*,YANG Chen-liu,LI Yu,LIANG Yan-yu,LI Dan,MENG Yuan-yuan,DAI Xiao-ning
(College of Food and Bioengineering,Henan University of Science and Technology,Luoyang 471023,China)
ABSTRACTCollagenase is a kind of enzymes that specifically hydrolyze natural collagen or gelatin.In order to prepare a new type of collagen protease and explore its ability to degrade collagen,a novel bone specific collagenase (BSC) was obtained from Bacillus cereus crude enzyme liquid through the purification steps of ammonium sulfate precipitation,DEAE-Sepharose Fast Flow ion exchange chromatography and Sephadex G-100 gel chromatography.Furthermore,its molecular weight of the purified enzyme,substrate specificity and degradation ability were analyzed.What's more,the kinetic model of hydrolyzing bovine bone collagen was constructed.The results showed that the specific activity of BSC was 5.57×103U/mg,the purification times was up to 42.85 times,and its molecular weight was about 52.0 kDa.The specificity analysis showed that the substrate was a bone collagen enzyme,and its ability to hydrolyze type I collagen was significant.The comparative test indicated that the hydrolysis capacity of BSC was higher than that of other proteases.The dynamic model of the enzymatic degradation of collagen was as follows:the degradation rate wasR=(583.813 6E0+1.296 7S0)exp(-0.119 0DH),degree of hydrolysis wasDH=8.403 4ln
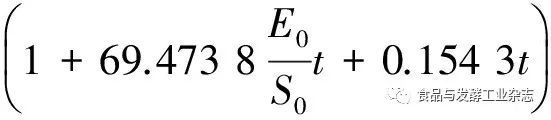
,Enzyme inactivation constant was K4=64.115 7 h-1.The results provided a novel collagenolytic protease for the development of animal bone collagen.
Key wordscollagen; purification; bone specific collagenase(BSC); kinetics; degradation
DOI:10.13995/j.cnki.11-1802/ts.015222
第一作者:博士,副教授(本文通讯作者,E-mail:yangliuyilang@126.com)。
基金项目:国家自然科学基金(31401622);公益性行业(农业)科研专项(201303084);河南省重点攻关项目(152102110080);河南省教育厅自然科学研究项目(13A550255);河南省重大专项(161100110900)
收稿日期:2017-07-17,改回日期:2017-09-0


